- Сульфат железа(III)
-
Сульфат железа(III) 
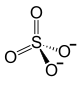
![\mathsf{ \!\ \Biggr]_3}](2b5b064cc300d7ab6b165cb3db3547a9.png)
Общие Систематическое наименование сульфат железа(III) Традиционные названия сернокислое железо(III), тетрасульфид(VI) железа(III) Химическая формула Fe2(SО4)3 Эмпирическая формула Fe2O12S3 Физические свойства Состояние (ст. усл.) безводный — светло-жёлтый порошок Молярная масса (безв.) 399.88 г/моль
(пентагидрат) 489.96 г/моль
Плотность (безв.) 3.097 г/см³
(пентагидрат) 1.898
(нонагидрат) 2.1 г/см³
Термические свойства Температура плавления (безв.) 480 °C (с разл.)
(нонагидрат) 175 °C
Температура разложения 600[1] °C Молярная теплоёмкость (ст. усл.) 271,75 Дж/(моль·К) Энтальпия образования (ст. усл.) −2580 кДж/моль Химические свойства Растворимость в воде (безв.) растворим, (нонагидрат) 81,5 г/100 мл Растворимость в остальных веществах (гидрат) мало растворим в спирте, нерастворим в этаноле
(безв.) растворим в разбавленной серной кислоте, ацетоне
Классификация Рег. номер CAS 10028-22-5
15244-10-7 (для всех гидратов с формулой Fe2(SО4)3·nН2О (где n=1, 3, 4, 6, 7, 9, 10, 12)
RTECS NO8505000 Безопасность ЛД50 (крысы, орально) 500 мг/кг Токсичность Сульфат железа(III) (лат. Ferrum sulfuricum oxydatum, нем. Eisensulfat (oxyd) Ferrisulfat[2]) — неорганическое химическое соединение, соль, химическая формула —
 .
.Содержание
Физические свойства
Безводный сульфат железа(III) — светло-желтые, парамагнитные, очень гигроскопичные кристаллы моноклинной сингонии, пространственная группа P21/m, параметры элементарной ячейки a = 0,8296 нм, b = 0,8515 нм,c = 1,160 нм, β = 90,5°, Z = 4. Есть данные, что безводный сульфат железа образовывает орторомбическую и гексагональную модификации. Растворим в воде и ацетоне, не растворяется в этаноле.
Из воды кристаллизуется в виде кристаллогидратов Fe2(SO4)3·n H2O, где n = 12, 10, 9, 7, 6, 3. Наиболее изученный кристаллогидрат — нонагидрат сульфата железа(III) Fe2(SO4)3·9H2O — жёлтые гексагональные кристаллы, параметры элементарной ячейки a = 1,085 нм, c = 1,703 нм, Z = 4. Хорошо растворяется в воде (440 г на 100 г воды) и этаноле, не растворяется в ацетоне. В водных растворах сульфат железа(III) из-за гидролиза приобретает красно-коричневый цвет.
При нагревании нонагидрат превращается при 98 °C в тетрагидрат, при 125 °C — в моногидрат и при 175 °C — в безводный Fe2(SO4)3, который выше 600 °C разлагается на Fe2O3 и SO3.
Нахождение в природе
Минерал, содержащий в себе смешанный сульфат железа-алюминия называется микасаит (англ. mikasaite), с химической формулой (Fe3+, Al3+)2(SO4)3 является минералогической формой сульфата железа(III). Этот минерал несет в себе безводную форму сульфата железа, поэтому встречается в природе очень редко. Гидратированные формы встречаются чаще всего, например:
- Кокимбит (англ. coquimbite) — Fe2(SO4)3·9H2O — нонагидрат — наиболее чаще встречающийся среди таковых.
- Паракокимбит (англ. paracoquimbite) — нонагидрат — наоборот — наиболее редко встречающийся минерал в природе.
- Корнелит (англ. kornelite) — гептагидрат — и куэнстедтит (англ. quenstedtite) — декагидрат — так же встречаются редко.
- Лаусенит (англ. lausenite) — гекса- или пентагидрат, малоизученный минерал.
Все перечисленные выше природные гидраты железа являются непрочными соединениями и в открытом состоянии быстро выветриваются.
Марс
Сульфат железа и ярозит были обнаружены двумя марсоходами: Спирит и Оппортьюнити. Эти вещества являются признаком сильных окислительных условий на поверхности Марса. В мае 2009 года марсоход Спирит застрял, когда он ехал по мягкому грунту планеты и наехал на залежи сульфата железа, скрытые под слоем обычного грунта[3]. Вследствие того, что сульфат железа имеет очень низкую плотность, то марсоход застрял настолько глубоко, что часть его корпуса коснулась поверхности планеты.
Получение
В промышленности сульфат железа(III) получают прокаливанием пирита или марказита с NaCl на воздухе:
или растворяют оксид железа(III) в серной кислоте:
В лабораторной практике сульфат железа(III) можно получить из гидроокиси железа(III):
Препарат той же чистоты можно получить окислением сульфата железа(II) азотной кислотой:
также окисление можно провести кислородом или оксидом серы:
Концентрированные серная и азотная кислоты окисляют сульфид железа до сульфата железа(III):
Дисульфид железа можно окислить концентрированной серной кислотой:
Сульфат-аммоний железа(II) (соль Мора) также можно окислить дихроматом калия. Вследствие данной реакции выделятся сразу четыре сульфата — железа(III), хрома(III), аммиака и калия, и вода:
Сульфат железа(III) можно получить как один из продуктов термического разложения сульфата железа(II):
Ферраты с разбавленной серной кислотой восстанавливаются до сульфата железа(III):
Нагрев пентагидрат до температуры 70—175 °C получим безводный сульфат железа(III):
Сульфат железа(II) можно окислить таким экзотическим окислителем, как оксид ксенона(III):
Химические свойства
Сульфат железа(III) в водных растворах подвергается сильному гидролизу по катиону, при этом раствор окрашивается в красновато-коричневый цвет:
Горячая вода или пар разлагают сульфат железа(III):
Безводный сульфат железа(III) при нагревании разлагается:
Растворы щелочей разлагают сульфат железа(III), продукты реакции зависят от концентрации щёлочи:
Если с щёлочью взаимодействует эквимолярный раствор сульфатов железа(III) и железа(II), то в результате получится сложный оксид железа:
Активные металлы (такие как магний, цинк, кадмий, железо) восстанавливают сульфат железа(III):
Некоторые сульфиды металлов (например, меди, кальция, олова, свинца, ртути) в водном растворе восстанавливают сульфат железа(III):
С растворимыми солями ортофосфорной кислоты образует нерастворимый фосфат железа(III) (гетерозит):
Использование
- Как реактив при гидрометаллургической переработке медных руд.
- Как коагулянт при очистке сточных вод, коммунальных и промышленных стоков.
- Как протрава при в окраске тканей.
- При дублении кожи.
- Для декапирования нержавеющих аустенитных сталей, сплавов золота с алюминием.
- Как флотационый регулятор для уменьшения плавучести руд.
- В медицине используется в качестве вяжущего и кровоостанавливающего средства.
- В химическое промышленности как окислитель и катализатор.
См. также
Примечания
- ↑ Сайт XuMuK.ru. Архивировано из первоисточника 22 апреля 2012. Проверено 4 апреля 2010.
- ↑ Сайт c-books.narod.ru. Архивировано из первоисточника 22 апреля 2012. Проверено 4 апреля 2010.
- ↑ Kenneth Chang Mars Rover’s 5 Working Wheels Are Stuck in Hidden Soft Spot (англ.). The New York Times (19 мая 2009). Архивировано из первоисточника 22 апреля 2012. Проверено 25 апреля 2011.
Соединения железаАрсениды железа • Бромид железа(II) (FeBr2) • Бромид железа(II,III) (Fe3Br8) • Бромид железа(III) (FeBr3) • Гексацианоферрат(II) калия (K4[Fe(CN)6]) • Гексацианоферрат(III) калия (K3[Fe(CN)6]) • Гидроксид железа(II) (Fe(OH)2) • Гидроксид железа(III) (Fe(OH)3) • Динитрозилдикарбонилжелезо (Fe(CO)2(NO)2) • Диоксоферрат(III) натрия (NaFeO2) • Дисульфид(2-) железа(II) (Fe(S2)) • Додекакарбонилтрижелезо (Fe3(CO)12) • Железистосинеродистая кислота (H4[Fe(CN)6]) • Железосинеродистая кислота (H3[Fe(CN)6]) • Иодид железа(II) (FeI2) • Иодид железа(II,III) (Fe3I8) • Карбиды железа • Карбонат железа(II) (FeCO3) • Метагидроксид железа (FeO(OH)) • Нитрат железа(II) (Fe(NO3)2) • Нитрат железа(III) (Fe(NO3)3) • Нитрид дижелеза (Fe2N) • Нитрид тетражелеза (Fe4N) • Нитропруссид калия (K2[Fe(CN)5NO]) • Нитропруссид натрия (Na2[Fe(CN)5NO]) • Нонакарбонилдижелезо (Fe2(CO)9) • Оксалат железа(II) (FeC2O4) • Оксалат железа(III) (Fe2(C2O4)3) • Оксид железа(II) (FeO) • Оксид железа(III) Fe2O3 • Оксид железа(II,III) (Fe3O4) • Оксид железа(III) (Fe2O3) • Оксихлорид железа FeOCl • Олеат железа(III) ((C17H33COO)3Fe) • Пентакарбонилжелезо (Fe(CO)5) • Резинат железа(III) ((C19H29COO)3Fe) • Соль Мора (FeSO4·(NH4)2SO4·6H2O) • Сульфат железа(II) (FeSO4) • Сульфат железа(III) (Fe2(SO4)3) • Сульфат железа(III)-калия (KFe(SO4)2) • Сульфид железа(II) (FeS) • Сульфид железа(II,III) (Fe3S4) • Сульфид железа(III) (Fe2S3) • Тартрат железа(II) (C4H4FeO6) • Тетракарбонилдигидриджелезо (H2Fe(CO)4) • Тетракарбонилжелезо (Fe(CO)4) • Тетранитрозил железа (Fe(NO)4) • Тиоцианат железа(II) (Fe(SCN)2) • Тиоцианат железа(III) (Fe(SCN)3) • Титанат железа(II) (FeTiO3) • Феррат калия (K2FeO4) • Фосфат железа(II) (Fe3(PO4)2) • Фосфат железа(II,III) (Fe4(PO4)3) • Фосфат железа(III) (FePO4) • Фосфиды железа • Фторид железа(II) (FeF2) • Фторид железа(III) (FeF3) • Хлорид железа(II) (FeCl2) • Хлорид железа(II,III) (Fe3Cl8) • Хлорид железа(III) (FeCl3) • Хромат железа(III) (Fe2(CrO4)3) • Хромит железа(II) (Fe(CrO2)2) Цианид железа(II) (Fe(CN)2)
СульфатыАлюм (KAl(SO4)2•12H2O) • Аммоний сульфата алюминия ((NH4)Al(SO4)2) • Аммоний-железо сульфат (NH4Fe(SO4)2) • Аммоний-железо(II) сульфат ([NH4]2[Fe][SO4]2) • Аммоний-железо(III) сульфат (NH4Fe(SO4)2) • Аммоний-церий(IV) сульфат ((NH4)4Ce(SO4)4) • Гептагидрат сульфата магния (MgSO4) • Гидросульфат аммония ((NH4)HSO4) • Гидросульфат калия (KHSO4) • Гидросульфат натрия (NaHSO4) • Дисульфат калия (K2S2O7) • Дисульфат натрия (Na2S2O7) • Железа(III) основный сульфат ([Fe3(SO4)5](OH)2) • Квасцы • Купорос • Оксид-сульфат титана (TiOSO4) • Олеум (H2SO4•xSO3) • Пиросерная кислота (H2S2O7) • Серная кислота (H2SO4) • Соли Туттона • Сульфат актиния(III) (Ac2(SO4)3) • Сульфат алюминия (Al2(SO4)3) • Сульфат алюмонатрия (NaAl(SO4)2) • Сульфат аммония ((NH4)2SO4) • Сульфат бария (BaSO4) • Сульфат бериллия (BeSO4) • Сульфат ванадила (VOSO4) • Сульфат ванадия(III) (V2(SO4)3) • Сульфат висмута (Bi2(SO4)3) • Сульфат гидроксиаммония ((NH3OH)2SO4) • Сульфат железа(II) (FeSO4) • Сульфат железа(III) (Fe2(SO4)3) • Сульфат индия(III) (In2(SO4)3) • Сульфат иридия(III) (Ir2(SO4)3) • Сульфат кадмия (CdSO4) • Сульфат калия (K2SO4) • Сульфат кальция (CaSO4) • Сульфат кобальта(II) (CoSO4) • Сульфат кобальта(III) (Co2(SO4)3) • Сульфат лития (Li2SO4) • Сульфат магния (MgSO4) • Сульфат марганца(II) (MnSO4) • Сульфат марганца(III) (Mn2(SO4)3) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфат натрия (Na2SO4) • Сульфат никеля(II) (NiSO4) • Сульфат олова(II) (SnSO4) • Сульфат празеодима (Pr2(SO4)3) • Сульфат ртути(I) (Hg2SO4) • Сульфат ртути(II) (HgSO4) • Сульфат свинца(II) (PbSO4) • Сульфат серебра (Ag2SO4) • Сульфат стронция (SrSO4) • Сульфат сурьмы (Sb2(SO4)3) • Сульфат таллия(I) (Tl2SO4) • Сульфат таллия(III) (Tl2(SO4)3) • Сульфат тетраамина меди (Cu(NH3)4SO4) • Сульфат титана(III) (Ti2(SO4)3) • Сульфат титана(IV) (Ti(SO4)2) • Сульфат урана (U(SO4)2) • Сульфат уранила (UO2SO4) • Сульфат хрома(III) (Cr2(SO4)3) • Сульфат хрома(III)-калия (KCr(SO4)2) Сульфат цезия (Cs2SO4) • Сульфат церия(IV) (Ce(SO4)2) • Сульфат цинка (ZnSO4) • Сульфат циркония (Zr(SO4)2)
Растворимость кислот, оснований и солей в водеH+ Li+ K+ Na+ NH4+ Ba2+ Ca2+ Mg2+ Sr2+ Al3+ Cr3+ Fe2+ Fe3+ Ni2+ Co2+ Mn2+ Zn2+ Ag+ Hg2+ Hg22+ Pb2+ Sn2+ Cu+ Cu2+ OH− P P P — P М Н М Н Н Н — Н Н Н Н Н — — Н Н Н Н F− P Н P P Р М Н Н М Р Н Н Н Р Р М Р Р М М Н Р Н Р Cl− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н Р Н М — Н Р Br− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н М Н М Р H Р I− P P P P Р Р Р Р Р Р ? Р — Р Р Р Р Н Н Н Н М Н — S2− P P P P — Р М Н Р — — Н — Н Н Н Н Н Н Н Н Н Н Н SO32− P P P P Р М М М Н ? ? М ? Н Н Н М Н Н Н Н ? Н ? SO42− P P P P Р Н М Р Н Р Р Р Р Р Р Р Р М — Н Н Р Р Р NO3− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р — Р — Р Р NO2− P P P P Р Р Р Р Р ? ? ? ? Р М ? ? М ? ? ? ? ? ? PO43− P Н P P — Н Н Н Н Н Н Н Н Н Н Н Н Н Н ? Н Н Н Н CO32− М Р P P Р Н Н Н Н — — Н — Н Н — Н Н — Н — — ? — CH3COO− P Р P P Р Р Р Р Р — Р Р — Р Р Р Р Р Р М Р — Р Р CN− P Р P P Р Р Р Р Р ? Н Н — Н Н Н Н Н Р Н Р — — Н SiO32− H Н P P ? Н Н Н Н ? ? Н ? ? ? Н Н ? ? ? Н ? ? ? Категории:- Соединения железа
- Сульфаты
- Неорганические вещества
Wikimedia Foundation. 2010.


















![~\mathsf{Fe[(H_2O)_6]^{3+} + H_2O \rightleftarrows Fe[(H_2O)_5(OH)]^{2+} + H_3O^+;~~~~~~p\mathit{K} = 2,17}](e2a5603a986c167e81f131dd53e39a4c.png)
![~\mathsf{Fe[(H_2O)_5(OH)]^{2+} + H_2O \rightleftarrows Fe[(H_2O)_4(OH)_2]^{+} + H_3O^+;~~~~~~p\mathit{K} = 3,26}](5da2b2bf46d27ccbd623b2b3bce8c377.png)
![~\mathsf{[2Fe(H_2O)_6]^{3+} + 2H_2O \rightleftarrows [Fe_2(H_2O)_8(OH)_2]^{4+} + 2H_3O^+;~~~~~~p\mathit{K} = 2,91}](f7a425583f6f8a01c25555f9c5c4b733.png)








