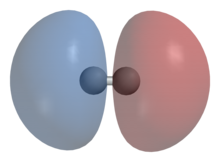
- Молекула водорода
-
Моле́кула водоро́да — простейшая молекула, состоящая из двух атомов водорода. В её состав входят два ядра атомов водорода и два электрона. Вследствие взаимодействия между электронами и ядрами образуется ковалентная химическая связь. Кроме основной изотопной модификации H2, существуют разновидности, в которых один или оба атома протия заменены другими изотопами водорода — дейтерием или тритием: HD, HT, D2, DT, T2. Симметричность или несимметричность молекулы имеет значение при её вращении.
Содержание
Модели молекулы водорода
Н.Бор ещё в 1913 году дал описание модели молекулы водорода[1]. Согласно Бору, два внешних электрона, образующих молекулу, вращаются по одной и той же орбите вокруг линии, проходящей через ядра обоих атомов, и удерживают последние на определённом расстоянии друг от друга (рис.1). Боровская модель химической связи давала чёткую картину образования молекулярного водорода — динамическое равновесие системы, содержащей два протона, удерживающихся на определённом расстоянии друг от друга (d), притяжением кольца из двух электронов. При этом модель Н.Бора отражала кулоновскую электронную корреляцию — оба электрона за счёт электростатического отталкивания находятся в диаметрально противоположных точках электронного кольца вокруг линии, проходящей через ядра обоих атомов молекулы водорода.
Также как и боровская модель атома, боровская модель молекулы водорода не отражала и не могла отражать волновую природу электрона и статистическую интерпретацию волновой функции. Здесь уместно дополнить боровскую модель молекулы водорода достижениями квантовой механики, аналогично боровской модели атома. В этом случае гипотетическое кольцо электронов в модели молекулы водорода трансформируется в геометрическое место расположения плотности вероятности нахождения связывающих электронов. Электронную пару следует представлять электронным облаком в форме кольца, баранки, тора. При этом предполагается, что электроны в торе удалены друг от друга на максимально возможное расстояние, а электронная плотность в молекуле водорода имеет минимум — «кулоновскую дырку» на линии, соединяющей ядра молекулы водорода. Наиболее вероятный радиус электронного тора (re) определяется боровским радиусом a0 и межъядерным расстоянием (d)
re2 = a02 — (d/2)2; re = 0,377 Å.
 Рис.2.Контурная карта электронной плотности для молекулы водорода[2]
Рис.2.Контурная карта электронной плотности для молекулы водорода[2]
В теории молекулярных орбиталей, разработанной в 1927—1932 г.г. Ф.Хундом, Р.Малликеном и др., модель молекулы водорода описывали контурными картами электронной плотности (рис.2).
Карта строится как разность между электронной плотностью молекулы и несвязанных атомов. Сплошные линии контурной карты отражают области увеличения электронной плотности (в единицах заряда электрона). Пунктирные — области её уменьшения в молекуле по сравнению с электронной плотностью несвязанных атомов водорода, сближенных на равновесное расстояние.[2]
Поскольку в теории молекулярных орбиталей учитывается лишь фермиевская корреляция электронов, поэтому электронная плотность в молекуле водорода сконцентрирована на линии, соединяющей ядра молекулы (см. рис.2).
Квантово-механическую теорию ковалентной связи в молекуле водорода разработали в 1927 году Вальтер Гайтлер и Фриц Лондон. Выполненный ими расчёт волновых функций явился основой теории валентных связей. В этой теории модель молекулы водорода описывали перекрыванием атомных орбиталей атомов водорода (1S типа). Схема перекрывания электронных облаков, образующих сигма-связь молекулы водорода, совпадает с линией соединения атомных центров молекулы (рис.3).
Расчёт молекулы водорода в основном сводится к определению интеграла перекрытия атомных орбиталей.
Гамильтониан
Гамильтониан молекулы водорода H2 записывается в виде

-
-
-
-
-
-
-
-
-
 ,
,
-
-
-
-
-
-
-
-
-
где M — масса протона, m — масса электрона,
 — координаты ядер,
— координаты ядер,  — координаты электронов.
— координаты электронов.В адиабатическом приближении задача нахождения энергетических состояний молекулы водорода разбивается на два этапа. На первом этапе рассматривается только электронная подсистема, а ядра считаются зафиксированными в точках
 и
и  .
.Гамильтониан электронной подсистемы имеет вид
 ,
,
Гамильтониан молекулы водорода симметричен относительно переменных
 и
и  , то есть не изменяется при смене нумерации электронов. Кроме того, он не зависит от спиновых переменных.
, то есть не изменяется при смене нумерации электронов. Кроме того, он не зависит от спиновых переменных.Волновые функции
Исходя из принципа тождественности частиц и учитывая то, что электроны являются фермионами, волновая функция молекулы водорода должна быть антисимметричной относительно перестановки электронов. Независимость гамильтониана от спиновых переменных позволяет выбрать её в виде произведения двух функций, одна из которых зависит только от координат и называется координатной волновой функцией, а вторая зависит только от спинов и называется спиновой функцией.
Существуют два возможных типа спиновых функций для двух электронов: с параллельными спинами и с антипараллельными спинами. Функции с параллельными спинами симметричны относительно перестановки электронов и образуют триплетные состояния, в которых суммарный спин равен единице. Функции с антипараллельными спинами образуют синглетные состояния с нулевым суммарным спином (см. Мультиплетность, Состояние (квантовая механика)). Они антисимметричны относительно перестановки электронов.
Поскольку волновая функция электрона должна быть антисимметричной относительно перестановки, она может быть произведением либо
- симметричной координатной функции на антисимметричную спиновую функцию, либо
- антисимметричной координатной функции на симметричную спиновую функцию.
Симметричную и антисимметричную координатные функции основного состояния в нулевом приближении теории возмущений можно построить исходя из волновых функций основного состояния атома водорода
 .
.Первый член каждой из приведенных волновых функций отвечает локализации электрона, пронумерованного индексом 1 на атоме с индексом 1 и электрона, пронумерованного индексом 2 на атоме с индексом 2. Второй член отвечает ситуации, когда первый электрон принадлежит второму атому, а второй — первому. При смене нумерации электронов первая (симметричная) функция не меняется, вторая (антисимметричная) — меняет знак.
Энергия электронных состояний
Энергия электронных состояний находится усреднением гамильтониана на волновых функциях
 .
.
Для двух возможных волновых функций основного состояния она приобретает вид
 ,
,
где
 — расстояние между ядрами,
— расстояние между ядрами,  — значение энергии основного состояния атома водорода,
— значение энергии основного состояния атома водорода,  — интеграл перекрытия, который определяется выражением
— интеграл перекрытия, который определяется выражением ,
,
 — кулоновский интеграл, определяемый как
— кулоновский интеграл, определяемый как![Q(R) = e^2 \int \psi^2_{1s}(|\mathbf{r}_1 - \mathbf{R}_1|) \psi^2_{1s}(|\mathbf{r}_2 - \mathbf{R}_2|)
\left[ \frac{1}{|\mathbf{r}_1 -\mathbf{r}_2|} - \frac{1}{|\mathbf{r}_1 -\mathbf{R}_2|} - \frac{1}{|\mathbf{r}_2 -\mathbf{R}_1|} \right] dV_1 dV_2](ce29ae941f494f67c708c8edbd1ba74e.png) ,
,
 — обменный интерграл, равный
— обменный интерграл, равный
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
![\left. - \frac{1}{|\mathbf{r}_1 -\mathbf{R}_2|} - \frac{1}{|\mathbf{r}_2 -\mathbf{R}_1|} \right] dV_1 dV_2](69cccb624a5622f849040c7dc9ec31f7.png) .
.
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
Энергия молекулы водорода состоит из удвоенной энергии атома водорода, энергии кулоновского отталкивания между ядрами и членов, определяющих взаимодействие электронов между собой и с другим ядром. В зависимости от спинового состояния в формуле для
 следует выбирать знак «+» или знак «-». Знак «+» отвечает синглетному состоянию, знак «-» — триплетному.
следует выбирать знак «+» или знак «-». Знак «+» отвечает синглетному состоянию, знак «-» — триплетному.Величина
 — это средняя энергия кулоновского взаимодействия между двумя электронами и электронов с «чужим ядром». Величина
— это средняя энергия кулоновского взаимодействия между двумя электронами и электронов с «чужим ядром». Величина  определяет вклад в энергию обменного взаимодействия, которая не имеет аналога в классической механике. Именно этот член определяет существенное различие между синглетными и триплетными состояниями.
определяет вклад в энергию обменного взаимодействия, которая не имеет аналога в классической механике. Именно этот член определяет существенное различие между синглетными и триплетными состояниями.Зависимость энергии основного состояния от расстояния между ядрами
Ковалентная связь
Обменный интеграл для молеклы водорода в определённом диапазоне расстояний между атомами отрицательный. Вследствие этого, для синглетных состояний он обеспечивает дополнительное притягивание между ядрами атомов, а для триплетных — дополнительное отталкивание. Дополнительное притягивание обусловливает появление минимума электронной энергии на расстоянии приблизительно в 1,5 радиуса Бора (что соответствует приблизительно 75 пм). Этот минимум возникает только для синглетного состояния, то есть для антипараллельных спинов. Таким образом устанавливается ковалентная связь между атомами. Электроны двух атомов водорода «спариваются».
Насыщение ковалентной связи
Для параллельных спинов, то есть для триплетного состояния, дополнительный положительный вклад в энергию приводит к тому, что атому отталкиваются на любом расстоянии. Этим объясняется насыщение ковалентной связи. Молекула водорода может состоять только из двух атомов. Третий атом водорода не может образовать связь с молекулой потому, что его спин непременно будет параллельным одному из спинов электронов в составе молекулы. Параллельность спинов приводит к отталкиванию между ядрами на любом расстоянии.
Необходимо отметить, что на больших расстояниях между атомами они притягиваются в любых состояниях благодаря Ван-дер-Ваальсовому взаимодействию, которое, однако, намного слабее ковалентной связи. Ван-дер-Ваальсово взаимодействие не учитывается в приведенной теории, поскольку требует рассмотрения возбуждённых состояний высших, чем 1s-орбиталь.
Движение ядер в молекуле водорода
Гамильтониан, описывающий относительное движение двух ядер в молекуле водорода имеет вид
 ,
,
где
 — приведённая масса двух ядер,
— приведённая масса двух ядер,  — энергия синглетного электронного состояния, зависящая от расстояния между ядрами (определена в предыдущем разделе),
— энергия синглетного электронного состояния, зависящая от расстояния между ядрами (определена в предыдущем разделе),  — оператор углового момента, описывающий вращение молекулы.
— оператор углового момента, описывающий вращение молекулы.Вращение
Оператор углового момента коммутирует с гамильтонианом, поэтому собственные функции гамильтониана можно выбрать общими с собственными функциями оператора углового момента, то есть сферические гармоники:
 .
.
Вклад вращения в энергию молекулы равен
 .
.
Этот вклад мал, потому, что массы ядер намного больше, чем массы электронов. Он зависит от расстояния между ядрами R. При колебаниях ядер это расстояние меняется, поэтому вращательное движение, строго говоря, невозможно отделить от колебательного. Однако при малых l и при малых энергиях колебательного движения можно считать, что R равняется определённому среднему значению.
Вращательные уровни вырождены относительно магнитного квантового числа ml. Кратность вырождения 2l+1.
Колебания атомов
Вблизи минимума функцию
 можно разложить в ряд Тейлора, ограничившись только квадратичным членом.
можно разложить в ряд Тейлора, ограничившись только квадратичным членом. ,
,
где
Таким образом, задача об энергетических состояниях колебания ядер сводится к задаче квантового гармонического осциллятора. Следовательно, для низших колебательных и вращательных уровней энергия молекулы водорода равна
 ,
,
где
 — колебательное квантовое число.
— колебательное квантовое число.Низшая энергия колебания
 отвечает нулевым колебаниям.
отвечает нулевым колебаниям.При больших значениях квантовых чисел n и l колебательное и вращательное движение разделить невозможно.
Таким образом, энергию молекулы при малых квантовых числах можно записать в виде трёх слагаемых — электронного, колебательного и вращательного:
Малым параметром задачи является отношение массы электрона к массе протона. Электронное слагаемое не зависит от этого отношения, колебательное пропорционально
 , вращательное пропорционально
, вращательное пропорционально  . Поэтому
. Поэтому .
.
Следовательно, электронный уровень расщепляется на несколько колебательных, каждый из которых, в свою очередь, расщепляется на вращательные. Поскольку энергии вращательных уровней близки, то в оптических спектрах они сливаются в полосы — образуется полосатый спектр, который наблюдается для молекулы HD. Для симметричной молекулы H2 переходы между орбитальными и колебательными уровнями запрещены правилами отбора, поэтому молекулярный протий не поглощает в инфракрасной области.
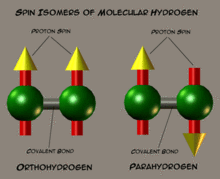
Пара- и ортоводород
Ядра атомов водорода, входящие в состав молекулы, являются протонами — фермионами со спином 1/2. По правилам сложения спинов ядерный спин молекулы может быть 0 или 1. Молекулы водорода с суммарным ядерным спином 0 называют параводородом, а молекулы с суммарным ядерным спином 1 и тремя возможными проекциями (−1, 0, 1) называют ортоводородом. В состоянии термодинамического равновесия при комнатной температуре отношение между ортоводородом и параводородом составляет 3:1. Однако при низких температурах в состоянии термодинамического равновесия молекулы параводорода доминируют благодаря разным вращательным свойствам: параводород является симметричным ротатором, ортоводород — несимметричным ротатором. Переход ортоводорода в параводород — медленный процесс, и состояние термодинамического равновесия при низких температурах устанавливается долго.
Характеристики молекулы водорода
Межъядерные расстояния и энергии диссоциации молекул водорода, его изотопов и молекулярного иона водорода[3]
Молекула Межъядерное расстояние,Å Энергия диссоциации, Эв H2 0,7416 4,477 HD 0,7414 4,512 D2 0,7416 4,555 DT 0,7416 4,570 T2 0,7416 4,588 HT 0,7416 4,524 H2+ 1,06 2,648 Константы реакции диссоциации молекулярного водорода (Kp) и степень превращения (α) в зависимости от абсолютной температуры[4]:
T, к 2000 3000 4000 5000 6000 8000 Кр 2,62 · 10-6 2,47 · 10-2 2,52 4,09 · 10 2,62 · 102 2,70 · 103 α 8,10 · 10-4 7,83 · 10-2 0,621 0,954 0,992 0,999 См. также
- Молекулярный ион водорода
- Рекомбинация (химия)
- Боровская модель химической связи
- Кулоновская электронная корреляция
- Статистическая интерпретация волновой функции
- Теория молекулярных орбиталей
- Теория валентных связей
Примечания
- ↑ Бор Н. Избранные научные труды (статьи 1909-1925 г.г). — М.: Наука, 1973. — Т. 1. — С. 133. — 584 с.
- ↑ 1 2 Химический энциклопедический словарь / гл. редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1983. — С. 646. — 792 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — М.-Л.: ГНТИ Химической литературы, 1962. — Т. 1. — С. 338. — 1072 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — М.-Л.: ГНТИ Химической литературы, 1964. — Т. 3. — С. 24. — 1008 с.
Литература
- Білий М. У. Атомна фізика. — Київ: Вища школа, 1973. (укр.)
- Федорченко А. М. Теоретична фізика. Квантова механіка, термодинаміка і статистична фізика. Т.2. — Київ: Вища школа, 1993.
- Юхновський І. Р. Основи квантової механіки. — Київ: Либідь, 2002.
- Ландау Л. Д., Лившиц Е. М. Теоретическая физика. т. ІІІ. Квантовая механика. Нерелятивистская теория. — М.: Наука, 1974.
Категории:- Квантовая механика
- Водород
- Молекулы
Wikimedia Foundation. 2010.