- Вестерн блоттинг
-
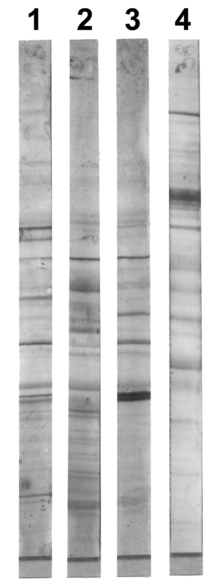 Вестерн-блот анализ белков, разделенных при помощи градиентного электрофореза в полиакриламидном геле в присутствии SDS.[1]
Вестерн-блот анализ белков, разделенных при помощи градиентного электрофореза в полиакриламидном геле в присутствии SDS.[1]
Вестерн блоттинг (белковый иммуноблот, англ. Western blot) — аналитический метод, используемый для определения специфичных белков в образце. На первом этапе использует электрофорез белков в полиакриламидном геле для разделения денатурированных полипептидов по длине (как правило, в присутствии SDS) или по трехмерной структуре белка (в нативном состоянии). Далее белки переносятся на нитроцеллюлозную мембрану или PVDF, затем детектируются с использованием антител, специфичных к заданному белку.[2][3]
Существует множество коммерческих компаний, специализирующихся на производстве антител (как моноклональных так и поликлональных) к десяткам тысяч различных белков.[4]
Вестерн-блоттинг используется в молекулярной биологии, биохимии, генетике и в других естественно-научных дисциплинах.
Другие сходные методы используют антитела для определения белков в тканях и клетках посредством иммуноокрашивания и иммуноферментного анализа (ИФА, англ. ELISA).
Вестерн-блоттинг был разработан в лаборатории Джорджа Старка (англ. George Stark) в Стэнфорде. Название вестерн блот было дано технике У. Нейлом Бурнеттом (англ. W. Neal Burnette)[5] и является игрой слов от названия Саузерн блоттинг, — методики определения ДНК, разработанной ранее Эдвином Саузерном. Аналогичный метод определения РНК называется нозерн блоттингом, детекция посттрансляционных модификаций белков называется истерн блоттингом (англ. Eastern blotting).
Содержание
Подготовка образца
Образец может быть взят из цельной ткани или из клеточной культуры. В большинстве случаев, твёрдые ткани сначала измельчаются механически с использованием блендера (для образцов большого объёма), с использованием гомогенизатора (меньшие объемы), или обработки ультразвуком. При этом бактерии, вирусы и другие компоненты окружающей среды также являются источником белков.
Различные детергенты, соли и буферы могут быть применены для улучшения лизиса клеток и растворения белков. Ингибиторы протеаз и фосфатаз часто добавляются для предотвращения расщепления образцов их собственными ферментами. Подготовка тканей часто выполняется при низких температурах, чтобы избежать денатурации белка.
Для разделения различных клеточных компартментов и органелл применяют комбинации биохимических и механических методик фракционирования, в том числе, различные типы фильтрации и центрифугирования.
Гель-электрофорез
Белки разделяются при помощи электрофореза в полиакриламидном геле. Разделение белков можно производить по изоэлектрической точке (pI), молекулярной массе, электрическому заряду или по сочетанию этих параметров.
Наиболее распространенный способ разделения белков — электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (англ. SDS) по Лэммли.[6] SDS вызывает денатурацию белков и поддерживает их в денатурированном состоянии, для разрушения вторичных и третичных структур белков используют восстановители дисульфидных связей, например, дитиотреитол и меркаптоэтанол. Денатурированные полипептиды мигрируют в электрическом поле через акриламидный гель к аноду, при этом белки меньшего размера двигаются быстрее и, таким образом, разделяются в соответствии с молекулярной массой. Концентрация акриламида определяет разрешающую способность геля — чем выше концентрация акриламида, тем лучше разрешение низкомолекулярных белков. Низкая концентрация акриламида улучшает разрешающую способность для высокомолекулярных белков. Также возможно использование двухмерного электрофореза (2-D). В таком случае разделение белков производят в двух направлениях — в соответствии с их изоэлектрической точкой в первом направлении, и в соответствии с молекулярной массой — во втором.
Образцы на гель наносят в карманы. Как правило, одну из «дорожек» оставляют для маркеров молекулярной массы (смеси белков с известными массами). После подачи напряжения белки двигаются в электрическом поле с различной скоростью. Отличия в скорости продвижения — электрофоретической подвижности приводит к разделению белков на полосы (англ. bands).
Перенос на мембрану
Чтобы сделать белки доступными для антител и дальнейшей детекции, их вместе с полоской геля переносят на мембрану, изготовленную из нитроцеллюлозы или поливинилиденфторида (англ. PVDF). Мембрана накладывается поверх геля, а поверх неё кладут стопку фильтровальной бумаги. Всю стопку помещают в буфер для переноса, который продвигается верх по бумаге под действием капиллярных сил, уносит с собой белки. Другой метод переноса белков называется электроблоттингом и использует электрический ток, который переносит белки из геля на мембрану. Белки перемещаются из геля на мембрану с сохранением своего расположения. В результате этого «промакивания» (от. англ. blotting) процесса белки удерживаются на тонком поверхностном слое мембраны для детекции. Оба варианта мембран используют из-за их свойства неспецифично связывать белки. Связывание белков основано как гидрофобных взаимодействиях, так и на электростатических взаимодействиях между мембраной и белком. Нитроцеллюлозная мембрана дешевле PVDF, но гораздо более хрупкая и хуже выдерживает повторное нанесение меток.
Единообразие и общая эффективность переноса белков из геля на мембрану может быть проверена окрашиванием мембраны красителями Coomassie blue или Ponceau S. Coomassie наиболее распространенный из двух, а краситель Ponceau S обладает большей чувствительностью и лучше растворим в воде, что упрощает последующую отмывку и нанесение меток на мембрану.[7]
Блокирование
Как только выбрана мембрана за её способность связывать белки, выбраны антитела и целевой белок, должны быть приняты меры по исключению взаимодействия между мембраной и антителом, используемым для детекции целевого белка (ибо антитело само по себе белок). Блокирование неспецифичных связываний достигается помещение мембраны в разбавленный раствор белка — обычно бычий сывороточный альбумин (BSA) или нежирное сухое молоко (оба недорогие), с небольшим процентом детергента типа Tween 20. Белок из разбавленного раствора прикрепляется к мембране во всех местах, где не прикрепился целевой белок. Поэтому, при добавлении антител, им (антителам) нет свободного места на мембране, куда бы они могли прикрепиться, кроме сайтов связывания на специфичных целевых белках. Этот фоновый «шум» в окончательном продукте вестерн блота приводит к чистым результатам и исключению ложно-положительных.
Детекция
Во время процесса детекции мембрана «метится» исследуемым белком с модифицированным антителом, которое связано с репортёрным ферментом, который выдерживается на соответствующей подложке, приводя к колориметрической реакции и давая цвет. В силу различных причин, детекция проводится в два этапа, хотя сейчас доступен одношаговый метод детекции для определенных областей применения.
Антитела вырабатывают, воздействуя на класс хозяйских или на культуру иммунных клеток некоторым белком (или его частью).Обычно это часть иммунного ответа, а здесь (в анализе) собранные антитела используются как специфичный и чувствительный инструмент детекции, который напрямую связывается с белком.
После блокирования разведенный раствор первичных антител (обычно между 0.5 и 5 мкг/мл) инкубируется с мембраной и слегка встряхивается. Обычно раствор состоит из забуференного раствора соли с небольшим процентным содержанием детергента, иногда с сухим молоком или BSA. Раствор антител и мембрана могут быть вместе закрыты и инкубированы где угодно от 30 минут до оставления на ночь. Также они могут быть инкубированы при различных температурах, при повышенной температуре наблюдается лучшее связывание — и специфичное (целевого белка, «сигнал1») и неспецифичное («шум»).
После полоскания мембраны для удаления несвязавшихся первичных антител, мембрану выдерживают в других антителах, напрямую связывающихся с класс-специфическими участками первичных антител. Они известны как вторичные антитела и в соответствии с их целевыми свойствами, как правило называются по типу «anti-mouse», «anti-goat», и так далее. Антитела получают из животного источника (или животных — источников культуры гибридом); анти-мышиные вторичные антитела будут связываться с большинством первичных антител, полученных из мышей. Это создает некоторую экономию, позволяя отдельной лаборатории использовать один источник массового производства антител, и ведет к намного более воспроизводимым результатам. Вторичные антитела обычно связывают с биотином или с репортёрным ферментом, таким как щелочная фосфатаза или пероксидаза хрена. Это значит, что несколько вторичных антител могут связываться с одним первичным и усиливать сигнал.
Наиболее распространенные, связанные с пероксидазой хрена вторичные антитела используются для разрезания хемилюминесцентного агента, и продукт реакции производит люминесцентное излучение пропорционально количеству белка. Лист светочувствительной фотографической пленки помещается напротив мембраны и подвергается действию излучения реакции, создавая изображение полос антител на блоте. Более дешевый, но менее чувствительный подход с использованием 4-хлоронафтольного окрашивания в смеси с 1 % перекисью водорода; реакция пероксидного радикала с 4-хлоронафтолом дает темно-коричневое окрашивание, которое регистрируется без использования специальной фотографической пленки.
Как и в методиках ELISPOT и ELISA, фермент может обеспечиваться молекулой субстрата, которая превращается ферментом в цветной продукт реакции, а он будет виден на мембране (смотри ниже, рисунок с синими бэндами).
Другой метод детекции вторичными антителами использует антитела со связанным флюорофором, который излучает в ближней инфракрасной области (NIR). Свет, излучаемый флюоресцентным красителем, постоянен и делает флюоресцентную детекцию более точным и чувствительным способом измерения разницы в сигнале, производимом белками, которые мечены антителами, на вестерн блоте. Белки могут быть определены количественно, так как сигнал рассчитывается как разница (излучения) по отношению ко всем белкам на мембране, измеренном в покое, к (излучению) хемилюминесценции, которая измеряется в динамике.[8]
Третий альтернативный метод использует радиоактивную метку вместо фермента, связанного с вторичным антителом, такую как меченный антитело-связывающий белок типа Белка А Staphylococcus с радиоактивным изотопом йода. Другие методы безопаснее, быстрее и дешевле, поэтому радиоактивная детекция используется редко.
Исторически процесс нанесения меток проводится в два этапа, потому что относительно проще произвести первичные и вторичные антитела в раздельных процессах. Это дает исследователям и компаниям огромные преимущества в плане гибкости, и добавляет шаг амплификации в процесс детекции. Учитывая появление высоко-пропускного анализа белка и низкий порог обнаружения, все же наблюдается интерес к развитию системы-в-один-шаг для нанесения меток, которая позволяет процессу проходить быстрее и с меньшими затратами. Она (система-в-один-шаг) требует антител-меток, которые распознавали бы исследуемый белок и одновременно несли маркер для детекции — метки, наиболее доступные для известных «белковых хвостов». Сначала метки инкубируют с мембраной в стиле метода-в-два-шага с первичными антителами, а затем они готовы для прямой детекции после серии промывок.
Анализ
После отмывки несвязавшихся меток, вестерн блот готов к детекции зондов, связавшихся с целевым белком. На практике, не во всех вестернах обнаруживают белки лишь по одному бэнду на мембране. Приблизительный размер вычисляют сравнивая окрашенные бэнды с маркерами молекулярной массы, добавленными при электрофорезе. Процесс повторят с структурными белками, такими как актин или тубулин, которые не меняют между экспериментами. Количество целевого белка зависит от количества контрольного структурного белка между группами. Этот прием обеспечивает коррекцию количества общего белка на мембране в случае ошибки или неполного переноса.
Колориметрическая детекция
Метод колориметрической детекции основан на инкубации вестерн блота с субстратом, который реагирует с репортерным ферментом (таким как пероксидаза хрена, англ. horseradish peroxidase), «сидящем» на вторичном антителе. Растворимый краситель переходит в нерастворимую форму другого цвета, осаждаясь рядом с ферментом и окрашивая мембрану. Рост пятна ограничивается смыванием растворимого красителя. Уровень количества белка оценивается денситометрически по интенсивности окрашивания или спектрофотометрически.
Хемилюминесцентная детекция
Метод хемилюминесцентной детекции основывается на инкубации нитроцеллюлозной мембраны с субстратом, который люминесцирует после взаимодействия с репортером вторичного антитела. Свет регистрируется фотопленкой или CCD-камерой, которая производит цифровую съемку вестерн блота. Изображение анализируется денситометрически, оценивая относительное количество окрашенного белка и даёт количественный результат в единицах оптической плотности. Новое программное обеспечение позволяет провести дальнейший анализ данных, например, определить молекулярный вес, если использовался соответствующий стандарт.

Радиоактивная детекция
Радиоактивные метки не нуждаются в ферментных субстратах, а позволяют помещать медицинскую радиографическую плёнку напротив вестерн блота, давая ей (плёнке) возможность взаимодействовать с метками и создавая тёмные участки, которые соответствуют полосам иследуемого белка (на изображении справа). Востребованность методов радиоактивной детекции снижается[источник не указан 713 дней] из-за их дороговизны, высокого риска для здоровья и безопасности и альтернатив, предоставляемых ECL.
Флюоресцентная детекция
Флюоресцентные метки возбуждаются светом и излучают более длинноволновый свет, регистрируемый фотосенсорами, такими как CCD-камера, снабженная соответствующими фильтрами эмиссии. Камера делает цифровой снимок вестерн блота, позволяя проводить дальнейший анализ полученных данных, такой как анализ молекулярного веса и количественный вестерн блот анализ.
Протоколы
- Western Blotting Protocol from Protocolmonkey
- Modified Western blotting protocols from Biotechniques
- Dr. Mark Barton Frank Lab protocol
- Kamps’s Western Blotting Protocol
- http://www.currentprotocols.com/protocol/et0801
- http://www.natureprotocols.com/2006/09/15/western_blot_analysis_of_subce.php
- http://www.prosci-inc.com/Western-Blot-Protocol.html
Примечания
- ↑ Hempelmann E, Schirmer RH, Fritsch G, Hundt E, Gröschel-Stewart U (1987). «Studies on glutathione reductase and methemoglobin from human erythrocytes parasitized with Plasmodium falciparum.». Mol Biochem Parasitol. 23 (1): 19–24. DOI:10.1016/0166-6851(87)90182-4. PMID 3553936.
- ↑ Towbin H, Staehelin T, Gordon J. (1979). «Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications.». Proc Natl Acad Sci U S A. 76 (9): 4350–4354. DOI:10.1073/pnas.76.9.4350. PMID 388439.
- ↑ Renart J, Reiser J, Stark GR (1979). «Transfer of proteins from gels to diazobenzyloxymethyl-paper and detection with antisera: a method for studying antibody specificity and antigen structure.». Proc Natl Acad Sci U S A. 76 (7): 3116–3120. DOI:10.1073/pnas.76.7.3116. PMID 91164.
- ↑ Western blot antibody. exactantigen.com. Проверено 29 января 2009.
- ↑ W. Neil Burnette (April 1981). «'Western blotting': electrophoretic transfer of proteins from sodium dodecyl sulfate — polyacrylamide gels to unmodified nitrocellulose and radiographic detection with antibody and radioiodinated protein A». Analytical Biochemistry 112 (2): 195–203. DOI:10.1016/0003-2697(81)90281-5. ISSN 0003-2697. PMID 6266278. Проверено 2008-04-03.
- ↑ U. K. Laemmli. Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4. Nature,1970; V.227, P.680 — 685
- ↑ A guide to methods in the biomedical … — Google Books
- ↑ Ambroz K., (2006). «Improving quantification accuracy for western blots» Image Analysis09/2006.[1]
См. также
Ссылки
- Western blot analysis of sub-cellular fractionated samples using the Odyssey Infrared Imaging System (a protocol)
- Western blot protocol including example buffers and reprobing procedure
Категория:- Методы молекулярной биологии
Wikimedia Foundation. 2010.
