- Окись кобальта
-
Ко́бальт — твёрдый вязкий блестящий голубовато-серый металл.
Кобальт / Cobaltum (Co) Атомный номер 27 Внешний вид простого вещества 
Свойства атома Атомная масса
(молярная масса)58,9332 а. е. м. (г/моль) Радиус атома 125 пм Энергия ионизации
(первый электрон)758,1 (7,86) кДж/моль (эВ) Электронная конфигурация [Ar] 3d7 4s2 Химические свойства Ковалентный радиус 116 пм Радиус иона (+3e) 63 (+2e) 72 пм Электроотрицательность
(по Полингу)1,88 Электродный потенциал 0 Степени окисления 3, 2, 0, -1 Термодинамические свойства простого вещества Плотность 8,9 г/см³ Удельная теплоёмкость 0,456 Дж/(K·моль) Теплопроводность 100 Вт/(м·K) Температура плавления 1 768 K Теплота плавления 15,48 кДж/моль Температура кипения 3143 K Теплота испарения 389,1 кДж/моль Молярный объём 6,7 см³/моль Кристаллическая решётка простого вещества Структура решётки гексагональная Период решётки 2,510 Å Отношение c/a n/a Температура Дебая 385,00 K Содержание
История
Происхождение названия
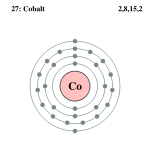 Схема атома кобальта
Схема атома кобальтаНазвание химического элемента кобальт происходит от нем. Kobold — домовой, гном. При обжиге содержащих мышьяк кобальтовых минералов выделяется летучий ядовитый оксид мышьяка. Руда, содержащая эти минералы, получила у горняков имя горного духа Кобольда. Древние норвежцы приписывали отравления плавильщиков при переплавке серебра проделкам этого злого духа. Вероятно, имя злого духа восходит к греческому «кобалос» — дым. Этим же словом греки называли лживых людей.
В 1735 году шведский минералог Георг Бранд сумел выделить из этого минерала неизвестный ранее металл, который и назвал кобальтом. Он выяснил также, что соединения именно этого элемента окрашивают стекло в синий цвет — этим свойством пользовались ещё в древних Ассирии и Вавилоне.
Нахождение в природе
Массовая доля кобальта в земной коре 4·10−3%. Кобальт входит в состав минералов: каролит CuCo2S4, линнеит Co3S4, кобальтин CoAsS, сферокобальтит CoCO3, смальтит CoAs2 и других. Всего известно около 30 кобальтосодержащих минералов. Кобальту сопутствуют железо, никель, марганец и медь. Содержание в морской воде приблизительно (1,7)·10−10%.
Получение
Кобальт получают в основном из никелевых руд, обрабатывая их растворами серной кислоты или аммиака. Также используется методы пирометаллургии. Для отделения от близкого по свойствам никеля используется хлор, гипохлорат кобальта (Co(ClO3)2) выпадает в осадок, а соединения никеля остаются в растворе.
Физические свойства
Кобальт — твердый металл, существующий в двух модификациях. При температурах от комнатной до 427 °C устойчива α-модификация. При температурах от 427 °C до температуры плавления (1494 °C) устойчива β-модификация кобальта (решетка кубическая гранецентрированная). Кобальт — ферромагнетик, точка Кюри 1121 °C.
Желтоватый оттенок ему придает тонкий слой оксидов.
Химические свойства
Оксиды
- На воздухе кобальт окисляется при температуре выше 300 °C.
- Устойчивый при комнатной температуре оксид кобальта состоит из смеси оксидов CoO и Co2O3, поэтому в справочниках можно встретить брутто формулу Co3O4.
- При высоких температурах можно получить α-форму или β-форму оксида CoO
- Все оксиды кобальта восстанавливаются водородом. Со3О4 + 4Н2 → 3Со + 4Н2О.
- Оксид кобальта (II) можно получить, прокаливая соединения кобальта (II), например: 2Со(ОН)2 + O2 → Co2O3 + Н2O.
Другие соединения
- При нагревании, кобальт реагирует с галогенами, причём соединения кобальта (III) образуются только с фтором. Co + 3F → CoF3, но, Co + 2Cl → CoCl2
- С серой кобальт образует 2 различных модификации CoS. Серебристо-серую α-форму (при сплавлении порошков) и черную β-форму (выпадает в осадок из растворов).
- При нагревании CoS в атмосфере сероводорода получается сложный сульфид Со9S8
- С другими окисляющими элементами, такими как углерод, фосфор, азот, селен, кремний, бор. кобальт тоже образует сложные соединения, являющиеся смесями где присутствует кобальт со степенями окисления 1, 2, 3.
- Кобальт способен растворять водород, не образуя химических соединений. Косвенным путем синтезированы два стехиометрических гидрида кобальта СоН2 и СоН.
- Растворы солей кобальта CoSO4, CoCl2, Со(NO3)2 придают воде бледно-розовую окраску. Растворы солей кобальта в спиртах темно-синие. Многие соли кобальта нерастворимы.
- Кобальт создаёт комплексные соединения. Чаще всего на основе аммиака.
Наиболее устойчивыми комплексами являются лутеосоли [Co(NH3)6]3+ желтого цвета и розеосоли [Co(NH3)5H2O]3+ красного или розового цвета.
- Также кобальт создаёт комплексы на основе CN−, NO2− и многих других.
- Хлорид кобальта
- Ионные комплексы кобальта
Применение
- Легирование кобальтом стали повышает её жаропрочность, улучшает механические свойства. Из сплавов с применением кобальта создают обрабатывающий инструмент: свёрла, резцы, и.т.п.
- Магнитные свойства сплавов кобальта находят применение в аппаратуре магнитной записи, а также сердечниках электромоторов и трансформаторов.
- Для изготовления постоянных магнитов иногда применяется сплав, содержащий около 50 % кобальта, а также ванадий или хром.
- Кобальт применяется как катализатор химических реакций.
- Кобальтат лития применяется в качестве высокоэффективного положительного электрода для производства литиевых аккумуляторов.
- Силицид кобальта отличный термоэлектрический материал и позволяет производить термоэлектрогенераторы с высоким КПД.
- Радиоактивный кобальт-60 (период полураспада 5,271 года) применяется в гамма-дефектоскопии и медицине.
- 60Со используется в качестве топлива в радиоизотопных источниках энергии.
Биологическая роль
Кобальт, один из микроэлементов, жизненно важных организму. Он входит в состав витамина В12 (кобаламин). Кобальт задействован при кроветворении, функциях нервной системы и печени, ферментативных реакциях. Потребность человека в кобальте 0,007-0,015 мг, ежедневно. В теле человека содержится 0,2 мг кобальта на каждый килограмм массы человека. При отсутствии кобальта развивается акобальтоз.
Токсикология
Избыток кобальта для человека вреден.
ПДК пыли кобальта в воздухе 0,5 мг/м³, в питьевой воде допустимое содержание солей кобальта 0,01 мг/л.
Токсическая доза (
Особенно токсичны пары октакарбонила кобальта Со2(СО)8.
Ссылки
Wikimedia Foundation. 2010.
