- олово
- О́ЛОВО -а; ср. Химический элемент (Sn), мягкий ковкий серебристо-белый металл (применяется для пайки, лужения, приготовления сплавов и т.п.).* * *о́лово(лат. Stannum), Sn, химический элемент IV группы периодической системы. Серебристо-белый металл, мягкий и пластичный; tпл 231,9°C. Полиморфно; так называемое белое олово (или β-Sn) с плотностью 7,28 г/см3 ниже 13,2°C переходит в серое олово (α-Sn) с плотностью 5,75 г/см3. На воздухе тускнеет, покрываясь плёнкой оксида, стойкой к химическим реагентам. Главные промышленные минералы — касситерит и станнин. Олово — компонент многих сплавов, например, подшипниковых (баббитов), типографских (гарт). Идёт на покрытие других металлов для защиты их от коррозии (лужение), на изготовление белой жести для консервных банок.
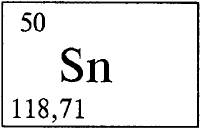 * * *ОЛОВОО́ЛОВО (лат. Stannum), Sn, химический элемент с атомным номером 50, атомная масса 118,710). Латинское «stannum» первоначально означало сплав серебра и свинца. «Оловом» в ряде славянских языков называли свинец. Химический символ олова Sn читается «станнум». Природное олово состоит из девяти стабильных нуклидов (см. НУКЛИД) с массовыми числами 112 (в смеси 0,96% по массе), 114 (0,66%), 115 (0,35%), 116 (14,30%), 117 (7,61%), 118 (24,03%), 119 (8,58%), 120 (32,85%), 122 (4,72%), и одного слабо радиоактивного олова-124 (5,94%). 124Sn — бета-излучатель, его период полураспада очень велик и составляет T1/2 = 1016–1017 лет. Олово расположено в пятом периоде в IVА группе периодической системы элементов Д. И. Менделеева. Конфигурация внешнего электронного слоя 5s25p2. В своих соединениях олово проявляет степени окисления +2 и +4 (соответственно валентности II и IV).
* * *ОЛОВОО́ЛОВО (лат. Stannum), Sn, химический элемент с атомным номером 50, атомная масса 118,710). Латинское «stannum» первоначально означало сплав серебра и свинца. «Оловом» в ряде славянских языков называли свинец. Химический символ олова Sn читается «станнум». Природное олово состоит из девяти стабильных нуклидов (см. НУКЛИД) с массовыми числами 112 (в смеси 0,96% по массе), 114 (0,66%), 115 (0,35%), 116 (14,30%), 117 (7,61%), 118 (24,03%), 119 (8,58%), 120 (32,85%), 122 (4,72%), и одного слабо радиоактивного олова-124 (5,94%). 124Sn — бета-излучатель, его период полураспада очень велик и составляет T1/2 = 1016–1017 лет. Олово расположено в пятом периоде в IVА группе периодической системы элементов Д. И. Менделеева. Конфигурация внешнего электронного слоя 5s25p2. В своих соединениях олово проявляет степени окисления +2 и +4 (соответственно валентности II и IV).
Металлический радиус нейтрального атома олова 0,158 нм, радиусы иона Sn2+ 0,118 нм и иона Sn4+ 0,069 нм (координационное число 6). Энергии последовательной ионизации нейтрального атома олова равны 7,344 эВ, 14,632, 30,502, 40,73 и 721,3 эВ. По шкале Полинга электроотрицательность олова 1,96, то есть олово находится на условной границе между металлами и неметаллами.
История открытия
Когда человек впервые познакомился с оловом точно сказать нельзя. Олово и его сплавы известны человечеству с древнейших времен. Упоминание об олове есть в ранних книгах Ветхого Завета. Сплавы олова с медью, так называемые оловянные бронзы (см. БРОНЗА), по-видимому, стали использоваться более чем за 4000 лет до нашей эры. А с самим металлическим оловом человек познакомился значительно позже, примерно около 800 года до нашей эры. Из чистого олова в древности изготовляли посуду и украшения, очень широко применяли изделия из бронзы.
Нахождение в природе
Олово — редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Содержание олова в земной коре составляет, по разным данным, от 2·10-4 до 8·10–3% по массе. Основной минерал олова — касситерит (см. КАССИТЕРИТ) (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (см. СТАННИН) (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn).
Получение
Для добычи олова в настоящее время используют руды, в которых его содержание равно или немного выше 0,1%. На первом этапе руду обогащают (методом гравитационной флотации или магнитной сепарации). Таким образом удается повысить содержание олова в руде до 40—70%. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Затем полученный таким образом оксид SnO2 восстанавливают углем или алюминием (цинком) в электропечах:
SnO2 + C = Sn + CO2. Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
Физические и химические свойства
Простое вещество олово полиморфно. В обычных условиях оно существует в виде бета-модификации (белое олово), устойчивой выше 13,2°C. Белое олово — это серебристо-белый, мягкий, пластичный металл, обладающий тетрагональной элементарной ячейкой, параметры a=0.5831, c=0.3181 нм. Координационное окружение каждого атома олова в нем — октаэдр. Плотность бета-Sn 7,29 г/см3 . Температура плавления 231,9°C, температура кипения 2270°C.
При охлаждении, например, при морозе на улице, белое олово переходит в альфа-модификацию (серое олово). Серое олово имеет структуру алмаза (кубическая кристаллическая решетка с параметром а = 0,6491 нм). В сером олове координационный полиэдр каждого атома — тетраэдр, координационное число 4. Фазовый переход бета-Sn ® альфа-Sn сопровождается увеличением удельного объема на 25,6%, что приводит к рассыпанию олова в порошок. В старые времена наблюдавшееся во время сильных холодов рассыпание оловянных изделий называли «оловянной чумой». В результате этой «чумы» пуговицы на обмундировании солдат, их пряжки, кружки, ложки рассыпались, и армия могла потерять боеспособность.
Из-за сильного различия структур двух модификаций олова разнятся и их электрофизические свойства. Так, бета-Sn — металл, а альфа-Sn относится к числу полупроводников (см. ПОЛУПРОВОДНИКИ). Ниже 3,72 К альфа-Sn переходит в сверхпроводящее состояние. Стандартный электродный потенциал E°Sn2+/Sn равен –0.136 В, а E пары °Sn4+/Sn2+ 0.151 В. При комнатной температуре олово, подобно соседу по группе германию, (см. ГЕРМАНИЙ) устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной пленки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150°C:
Sn + O2 = SnO2.
При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4, которая более характерна для олова, чем +2. Например:
Sn + 2Cl2 = SnCl4
С концентрированной соляной кислотой олово медленно реагирует:
Sn + 4HCl = SnCl4 + H2
Возможно также образование хлороловянных кислот составов HSnCl3, H2SnCl4 и других, например:
Sn + 3HCl = HSnCl3 + 2H2
В разбавленной серной кислоте олово не растворяется, а с концентрированной реагирует очень медленно. Состав продукта реакции олова с азотной кислотой зависит от концентрации кислоты. В концентрированной азотной кислоте образуется оловянная кислота b-SnO2·nH2O (иногда ее формулу записывают как H2SnO3). При этом олово ведет себя как неметалл:
Sn + 4HNO3 конц. = b-SnO2·H2OЇ + 4NO2 + H2O
При взаимодействии с разбавленной азотной кислотой олово проявляет свойства металла. В результате реакции образуется соль нитрат олова(II):
3Sn + 8HNO3 разб. = 3Sn(NO3)2 + 2NO + 4H2O.
При нагревании олово, подобно свинцу, может реагировать с водными растворами щелочей. При этом выделяется водород и образуется гидроксокомплекс Sn(II), например:
Sn + 2KOH +2H2O = K2[Sn(OH)4] + H2
Гидрид олова — станнан SnH4 — можно получить по реакции:
SnCl4 + Li[AlH4] = SnH4 + LiCl + AlCl3.
Этот гидрид весьма нестоек и медленно разлагается уже при температуре 0°C. Олову отвечают два оксида SnO2 (образующийся при обезвоживании оловянных кислот) и SnO. Последний можно получить при слабом нагревании гидроксида олова(II) Sn(OH)2 в вакууме:
Sn(OH)2 = SnO + H2O
При сильном нагреве оксид олова(II) диспропорционирует:
2SnO = Sn + SnO2
При хранении на воздухе монооксид SnO постепенно окисляется:
2SnO + O2 = 2SnO2.
При гидролизе растворов солей олова(IV) образуется белый осадок — так называемая альфа-оловянная кислота:
SnCl4 + 4NH3 + 6H2O = H2[Sn(OH)6] + 4NH4Cl.
H2[Sn(OH)6] = -SnO2·nH2OЇ + 3H2O.
Свежеполученная альфа-оловянная кислота растворяется в кислотах и щелочах:
a-SnO2·nH2O + KOH = K2[Sn(OH)6],
a-SnO2·nH2O + HNO3 = Sn(NO3)4 + H2O.
При хранении альфа-оловянная кислота стареет, теряет воду и переходит в бета-оловянную кислоту, которая отличается большей химической инертностью. Данное изменение свойств связывают с уменьшением числа активных HO–Sn группировок при стоянии и замене их на более инертные мостиковые –Sn–O–Sn– связи. При действии на раствор соли Sn(II) растворами сульфидов выпадает осадок сульфида олова(II):
Sn2+ + S2– = SnS
Этот сульфид может быть легко окислен до SnS2 раствором полисульфида аммония:
SnS + (NH4)2S2 = SnS2 + (NH4)2S
Образующийся дисульфид SnS2 растворяется в растворе сульфида аммония (NH4)2S:
SnS2 + (NH4)2S = (NH4)2SnS3. Четырехвалентное олово образует обширный класс оловоорганических соединений, используемых в органическом синтезе, в качестве пестицидов и других.
Применение
Важное применение олова — лужение железа и получение белой жести, которая используется в консервной промышленности. Для этих целей расходуется около 33% всего добываемого олова. До 60% производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит (см. БАББИТЫ)), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев (см. ПРИПОЙ). Олово способно прокатываться в тонкую фольгу — станиоль (см. СТАНИОЛЬ), такая фольга находит применение при производстве конденсаторов, органных труб, посуды, художественных изделий. Олово применяют для нанесения защитных покрытий на железо и другие металлы, а также на металлические изделия (лужение). Дисульфид олова SnS2 применяют в составе красок, имитирующих позолоту («сусальное золото»). Искусственный радионуклид олова 119Sn — источник гамма-излучения в мессбауэровской спектроскопии.
Физиологическое действие
О роли олова в живых организмах практически ничего не известно. В теле человека содержится примерно (1—2)· 10–4% олова, а его ежедневное поступление с пищей составляет 0,2—3,5 мг. Олово представляет опасность для человека в виде паров и различных аэрозольных частиц, пыли. При воздействии паров или пыли олова может развиться станноз — поражение легких. Очень токсичны некоторые оловоорганические соединения. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м3, ПДК олова в пищевых продуктах 200 мг/кг, в молочных продуктах и соках — 100 мг/кг. Токсическая доза олова для человека — 2 г.
Энциклопедический словарь. 2009.
