- ХИМИЧЕСКИЙ ПОТЕНЦИАЛ
- ХИМИЧЕСКИЙ ПОТЕНЦИАЛ
-
термодинамич. функция состояния, определяющая изменение потенциалов термодинамических при изменении числа ч-ц в системе и необходимая для описания св-в открытых систем (с перем. числом ч-ц).X. п. mi i-го компонента многокомпонентной системы равен частной производной от любого из термодинамич. потенциалов по количеству (числу ч-ц) этого компонента при пост. значениях остальных термодинамич. переменных, определяющих данный термодинамич. потенциал; напр. mi=(дF/дNi)T, V, Ni (F — свободная энергия, Т — темп-ра, V — объём, j?i). Т. о., в системах с перем. числом ч-ц в выражение для дифференциала термодинамич. потенциала следует добавить величину SimidNi, напр. dF=-SdT-pdV+SimidNi, где р — давление, S — энтропия. Наиболее просто X. п. связан с термодинамич. потенциалом G (см. ГИББСА ЭНЕРГИЯ) G=SimiNi;. Для однокомпонентной системы X. п. m=G/N, т. е. представляет собой энергию Гиббса, отнесённую к одной ч-це. Вследствие аддитивности G X. п. зависит, кроме давления и темп-ры, только от концентраций отд. компонентов, но не от числа ч-ц в каждом компоненте. В простейшем случае идеальных газов m зависит только от концентрации i-ro компонента mi=m=i+kTln(Ni/N), где N=SiNi — полное число ч-ц, (m=i— X. п. чистого i-ro компонента. Часто величины mi удобно использовать в кач-ве независимых термодинамич. переменных вместо Ni. В переменных Т, V, mi состояние системы характеризует термодинамич. потенциал W=F-SimiNi.X. п. явл. параметром в Гиббса большом каноническом распределении для систем с перем. числом ч-ц. В кач-ве нормировочной постоянной X. п. входит в распределения Больцмана, Бозе — Эйнштейна и Ферми — Дирака для ч-ц идеальных газов (см. СТАТИСТИЧЕСКАЯ ФИЗИКА). В системах, в к-рых применима статистика Больцмана или Бозе — Эйнштейна, X. п. всегда отрицателен. Для ферми-газа X. п. при нулевой темп-ре положителен и определяет граничную Ферми энергию (см. ФЕРМИ ПОВЕРХНОСТЬ) и вырождения температуру. Если полное число ч-ц в системе не фиксировано, а должно определяться из условия термодинамич. равновесия, как, напр., для фононов в тв. теле или для фотонов в случае равновесного теплового излучения, то равновесие характеризуется равенством нулю X. п.Понятие X. п. позволяет сформулировать условия равновесия термодинамического. Одно из условий состоит в том, что X. п. любого компонента одинаков в различных фазах и в разных местах одной фазы. Это обусловлено возможностью перераспределения ч-ц, приводящего к выравниванию X. п. Для систем в пространственно неоднородном внешнем поле равновесие означает, что mi =m0i+Ui(r)=const, где m0i— X. п. в отсутствие поля, Ui(r) — потенц. энергия ч-ц i-го компонента во внешнем поле. Для газа в поле тяжести это условие приводит к барометрической формуле для плотности газа. В случае заряж. ч-ц в электрич. поле (напр., в ПП) величину mi называют электрохим. потенциалом, оставляя название X. п. за m0i. Равенство значений X. п. для ч-ц одного компонента, находящихся в разных фазах, определяет условия равновесия при фазовых переходах (Гиббса правило фаз) и хим. реакциях (закон действующих масс), ионизац. равновесие (см. ИОНИЗАЦИЯ), св-ва растворов (законы Вант-Гоффа, Генри, Рауля) и т. д. Если для ч-ц одного из компонентов переход из одной части системы в другую невозможен, то для этого компонента условия постоянства X. п. нарушаются и в системе возникает осмотическое давление. X. п. был введён амер. физиком Дж. У. Гиббсом (1875) при рассмотрении хим. равновесия в многокомпонентных системах, отсюда его название. Численно X. п. выражается в ед. энергии на ед. массы (Дж/кг), на ед. кол-ва в-ва (Дж/моль) или на 1 ч-цу.
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- ХИМИЧЕСКИЙ ПОТЕНЦИАЛ
-
-термодинамич. функция состояния, определяющая изменение потенциалов термодинамических при изменении числа частиц в системе и необходимая для описания свойств открытых систем (с перем. числом частиц).
X. п. mi i -го компонента многокомпонентной системы равен частной производной от любого из термодинамич. потенциалов по кол-ву (числу частиц) этого компонента при пост. значениях остальных термодинамич. переменных, определяющих данный термодинамич. потенциал, напр. mi = (дF/дNi)T,V,N (F- свободная энергия, Т- темп-ра, V- объём, j
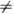 i). Т. о., в системах с перем. числом частиц в выражение для дифференциала, напр. dF, следует добавить величину
i). Т. о., в системах с перем. числом частиц в выражение для дифференциала, напр. dF, следует добавить величину 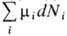 :
:
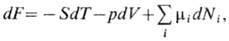
где р - давление, S -энтропия. Наиб. просто X. п. связан с термодинамич. потенциалом G (см. Гиббса энергия):
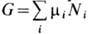 . Для однокомпонентной системы X. п. m = G/N,
. Для однокомпонентной системы X. п. m = G/N,
т. е. представляет собой энергию Гиббса, отнесённую к одной частице. Вследствие аддитивности G, кроме давления и темп-ры, X. п. зависит только от концентраций отд. компонентов, но не от числа частиц в каждом компоненте. В простейшем случае идеальных газовmi зависит только от концентрации i -го компонента:
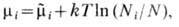
где
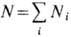 -полное число частиц, m~i-X. п. чистого i -го
-полное число частиц, m~i-X. п. чистого i -го
компонента. Часто величины mi удобно использовать в качестве независимых термодинамич. переменных вместо Ni. В переменных Т, V,mi состояние системы характеризует термодинамич. потенциал
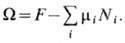
X. п. является термодинамич. параметром в большом каноническом распределении Гиббса для систем с перем. числом частиц. В качестве нормировочной постоянной X. п. входит в распределения Больцмана, Бозе - Эйнштейна и Ферми - Дирака для частиц идеальных газов (см. Статистическая физика). В системах, к к-рым применима статистика Больцмана или Бозе - Эйнштейна, X. п. всегда отрицателен. Для ферми-газаX. п. при нулевой темп-ре положителен и определяет граничную ферми-энергию (см. Ферми-поверхность )и вырождения температуру. Если
полное число частиц в системе не фиксировано, а должно определяться из условия термодинамич. равновесия, как, напр., для фононов в твёрдом теле или для фотонов в случае равновесного теплового излучения, то равновесие характеризуется равенством нулю X. п.
Понятие X. п. позволяет сформулировать условия равновесия термодинамического. Одно из условий состоит в том, что X. п. любого компонента одинаков в разл. фазах и в разных местах одной фазы. Это обусловлено возможностью перераспределения частиц, приводящего к выравниванию X. п. Для систем в пространственно неоднородном внеш. поле равновесие означает, что
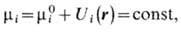
где mi0 - X. п. в отсутствие поля, Ui(r)- потенц. энергия частиц i -го компонента во внеш. поле. Для газа в поле тяжести это условие приводит к барометрич. ф-ле для плотности газа. В случае заряж. частиц в электрич. поле (напр., в полупроводниках) величину mi наз. э л е к т р о х им и ч е с к и м п о т е н ц и а л о м, оставляя название X. п. за mi0. Равенство значений X. п. для частиц одного компонента, находящихся в разных фазах, определяет условия равновесия при фазовых переходах ( Гиббса правило фаз )и хим. реакциях (закон действующих масс), ионизационное равновесие, свойства растворов (законы Вант-Гоффа, Генри, Рауля) и т. д. Если для частиц одного из компонентов переход из одной части системы в другую невозможен, то для этого компонента условия постоянства X. п. нарушаются и в системе возникает осмотическое давление (см. Осмос).
X. п. был введён Дж. У. Гиббсом (J. W. Gibbs) в 1875 при рассмотрении хим. равновесия в многокомпонентных системах, отсюда его название. Численно X. п. выражается в единицах энергии на единицу массы (Дж/кг), или на единицу кол-ва вещества (Дж/моль), или на 1 частицу.
Лит. см. при ст. Термодинамика. А. Э. Мейерович.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
