- ДЕЙТЕРИЙ
- ДЕЙТЕРИЙ
-
(от греч. deuteros-второй; лат. Deuterium), D или 2H,- тяжёлый стабильный изотоп водорода с массовым числом 2; содержание в природном водороде 0,0156% (по массе). Масса 2,0141018 а. е. м. Ядро Д.- дейтрон - состоит из 1 протона и 1 нейтрона. Д. открыт в 1932 Г. Юри (H. Urey) совм. с сотрудниками спектральным методом.
Большое различие масс Д. и протия (1H) обусловливает различие их свойств (изотопные эффекты). Так, t кип вещества, состоящего из молекул D2, -23,57К, межъядерное расстояние в молекуле D2-0,07416 нм, энергия диссоциации D2 (при OK) 439,68 кДж/моль (ср. с соответствующими значениями для H2 в ст. Водород). Скорости химических реакций с участием веществ, содержащих Д., могут быть в 5-10 раз выше или ниже, чем с участием таких же веществ, содержащих протий.
Д. выделяют на основе различий свойств протия и Д. Так, используют особенность изотопного обмена в системе вода - сероводород, применяют ректификацию жидкого водорода, многоступенчатый электролиз водных растворов и т. д.
Д. служит меченым стабильным индикатором при проведении разл. хим., биохим. и др. исследований. Тяжёлая вода D2O представляет собой лучший из известных замедлителей нейтронов. В водородных бомбах используется гидрид лития 6LiD; при взрыве водородной бомбы протекают термоядерные реакции:
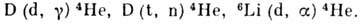
В будущем Д., возможно, станет основным ядерным топливом. С. С. Бердоносов.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
