- ЭЛЕКТРОЛИТЫ
- ЭЛЕКТРОЛИТЫ
-
в широком смысле — жидкие или твёрдые в-ва и системы, в к-рых присутствуют в заметной концентрации ионы, обусловливающие прохождение по ним электрич. тока (ионную проводимость); в узком смысле — в-ва, распадающиеся в р-ре на ионы.При растворении Э. под влиянием электрич. поля молекул растворителя происходит распад молекул Э. на отд. положительно и отрицательно заряж. ионы. Этот процесс наз. электролитической диссоциацией. По способности к электролитич. диссоциации а Э. условно делят на сильные (a»1) и слабые (а близка к 0). К сильным Э. относятся соли, нек-рые органич. кислоты и основания, к слабым — мн. органич. кислоты и основания. Степень диссоциации зависит также от природы растворителя, темп-ры, давления и др. факторов.Св-ва очень разбавл. растворов Э. удовлетворительно описываются статистич. теорией. Не слишком разбавленные Э. явл. сложными системами из ионов, недиссоциированных молекул и ионных пар, молекул растворителя и др., и теория таких систем, к-рая учитывала бы все вз-ствия, пока не создана.При прохождении электрич. тока через электролит на опущенных в него электродах происходят окислительно-восстановительные электрохим. реакции, в результате к-рых выделяются в свободном виде в-ва, входящие в состав Э. (см. ЭЛЕКТРОЛИЗ).
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- ЭЛЕКТРОЛИТЫ
-
- жидкие и твёрдые вещества, обладающие ионной проводимостью, т. е. проводники, в к-рых электрич. ток обусловлен движением ионов (проводники 2-го рода). Электрич ; ток в Э. сопровождается хим. реакциями на электродах(см. Электролиз). В нек-рых случаях наблюдается смешанная электропроводность - электронно-ионная (напр., в растворах щелочных металлов в жидком NH3); высокой проводимостью обладают Э. с протонной проводимостью.
К жидким Э. относятся расплавы солей (ионные жидкости), водные и неводные растворы солей, оснований и кислот, к-рые, в свою очередь, часто называют Э. К твёрдым Э. относятся ионные кристаллы с дефектами кристаллич. структуры с низкой ионной проводимостью (до 10-10 Ом . см ). К ним относятся также кристаллич. вещества, в к-рых подструктура отдельных ионов (в отличие от подструктуры остальных ионов) разупорядочена и электропроводность к-рых высока (см. Ионные суперпроводники). К твёрдым Э. относится и особый класс высокомолекулярных соединений - полиэлектролиты. В твёрдых Э. проводимость иногда может быть обусловлена движением ионов только одного знака (униполярная проводимость); к таким Э. относятся, напр., AgCl - в проводимости участвуют только ионы Ag+ , ВаСl2 - только ионы Cl-.
Наиболее широко применяются и хорошо изучены водные растворы Э. Они входят в состав живых организмов и участвуют во всех жизненно важных процессах. Свойства растворов Э. определяются степенью электролитич. диссоциации a, к-рая возрастает с ростом диэлектрич. проницаемости растворителя e. Поэтому для получения растворов Э. обычно используют полярные жидкости с высокой e (вода, спирт и др.). По степени диссоциации условно различают растворы сильных (a
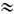 1) и слабых (a<<1) Э. Один и тот же Э. в разных растворителях может образовывать растворы с разной a.
1) и слабых (a<<1) Э. Один и тот же Э. в разных растворителях может образовывать растворы с разной a.
В полярных растворителях в растворах Э. создаются т. <н. с о л ь в а т н ы е с т р у к т у р ы - более или менее устойчивые комплексы иона с ближайшими молекулами растворителя, обусловленные межатомными взаимодействиями и межмолекулярными взаимодействиями. Между сольва-токомплексом и остальным раствором происходит непрерывный обмен молекулами, частота к-рого определяется характером и прочностью связей (энергией сольватации) в комплексе.
Электролитич. диссоциация приводит к увеличению общего числа частиц в растворе, поэтому свойства разбавленных растворов Э. отличаются от свойств обычных разбавленных растворов. Так, происходит увеличение осмотич. давления раствора и отклонение от ур-ния Вант-Гoффа (см. Осмос), понижение давления пара растворителя над раствором и его отклонение от Рауля закона, возрастание темп-ры кипения и снижение темп-ры замерзания раствора Э.
Весьма разбавленные растворы слабых Э. по свойствам близки к идеальным растворам и описываются классич. теорией электролитич. диссоциации. Свойства разбавленных растворов сильных Э. вследствие межионных взаимодействий отличны от свойств идеальных растворов и описываются теорией Дебая-Хюккеля. В рамках этой теории удовлетворительно объясняется концентрац. зависимость коэффициентов активности ионов, осмотич. коэффициентов, электропроводности, диффузии, вязкости, и др. При повышении концентрации сильных Э. необходимо учитывать размеры ионов и влияние сольватации на межионные взаимодействия.
При росте концентрации - в т. <н. переходной области - структура раствора меняется, т. к. мн. молекулы растворителя связаны с ионами Э. в сольватокомплексы. В области концентрированных растворов их структура приближается к структуре соответствующих ионных расплавов или даже кристаллов, что экспериментально подтверждено спектроскопическими и нейтронографическими исследованиями.
К ионным проводникам, к-рыми являются Э., применим Ома закон (для растворов Э.- за исключением областей сильных электрич. полей и высоких частот). Удельная электропроводность у Э. значительно ниже, чем у электронных проводников (обычно от 1 до 10-10 Ом . см -1).
В растворах Э. для характеристики проводимости пользуются также параметром молярной электропроводности
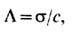
где s - уд. электропроводность раствора, с- мол. концентрация раствора. В разбавленных растворах сильных Э. а пропорциональна с, т. е. L практически постоянна. В более концентрированных растворах сильных Э. L падает из-за роста межионных взаимодействий; зависимость L от концентрации описывается ур-нием Онсагера:
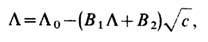
где B1. и В2 - ф-ции темп-ры вязкости и диэлектрич. проницаемости растворителя. В растворах слабых электролитов L падает с ростом с уже в разбавленных растворах из-за уменьшения степени диссоциации Э.
В электрич. полях большой напряжённости (св. 104- 105 В/см) и в полях высокой частоты L резко возрастает, т. к. вэтих случаях межионные и межмолекулярные взаимодействия значительно уменьшаются вследствие увеличения скорости ионов (см. также Химическая термодинамика).
Лит.: Багоцкий В. С., Основы электрохимии, М., 1988; Да-маскин Б. Б., Петрий О. А., Электрохимия, М., 1987; Ук-ше Е. А., Букун Н. Г., Твердые электролиты, М., 1977; Мищенко К. П., Полторацкий Г. М., Термодинамика и строение водных и неводных растворов электролитов, Л., 1976; Делимар-ский Ю. К., Марков Б. Ф., Электрохимия расплавленных солей, М., 1960. В. С. Багоцкий.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
