- СРОДСТВО К ЭЛЕКТРОНУ
- СРОДСТВО К ЭЛЕКТРОНУ
-
способность нек-рых нейтральных атомов, молекул и свободных радикалов присоединять добавочные эл-ны, превращаясь в отрицат. ионы. Мерой этой способности служит положит. энергия С. к э. c, равная разности энергии нейтрального атома (молекулы) в основном состоянии и энергии осн. состояния отрицат. иона, образовавшегося после присоединения эл-на.У большинства атомов С. к э. связано с тем, что их внеш. электронные оболочки не заполнены (см. АТОМ). Таковы атомы Н и элементов 1-й группы периодической системы элементов (имеющие лишь 1 внеш. s-эл-н), а также атомы элементов 3—7-й групп (неполное число р-эл-нов). Атомы с двумя внеш. s-эл-нами, как правило, не обладают С. к э. (щелочноземельные элементы, Hg и др.). Захват добавочного эл-на атомами Fe, Co и Ni, у к-рых в норм. состоянии тоже 2 внеш. s-эл-на, приводит, как принято считать, к заполнению свободного места на внутр. оболочке 3d.Величина c точно определена лишь для немногих атомов (данные о c молекул и радикалов б. ч. недостаточно надёжны). Прямо измерить c атомов можно, напр., определив длину волны света l0, соответствующую т. н. порогу фотоотщепления (фотоотрыва) эл-на от отрицат. иона: c=hс/l0 (с — скорость света в вакууме). Этим методом были установлены величины c атомов С, О, S, I, Сl. Типичные значения c атомов (в эВ): Н — 0,754; С — 1,2; О - 1,46; S — 2,07—2,33; F — 3,40—3,62; Сl — 3,82; I — 3,08—3,23. Величины ОС молекул и радикалов колеблются в широких пределах. В ряде случаев они составляют доли эВ, но для NO2 c>3 эВ, для ОН c»2 эВ, для CN c>3 эВ.
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- СРОДСТВО К ЭЛЕКТРОНУ
-
- свойство атомов или молекул образовыватьпрочную связь с электроном, т. е. отрицательный ион. Характеристикойтакой связи является энергия сродства атомов или молекул к электрону -энергия связи электрона в соответствующем отрицат. ионе, к-рая обычнообозначается ЕА (electron affinity). Эта энергия равна разности энергиинейтрального атома (молекулы) в основном состоянии и энергии осн. <состояния образовавшегося отрицат. иона. У большинства атомов С. к э. связанос тем, что их внеш. электронные оболочки не заполнены (см. Атом). Втабл. приводятся значения энергии С. к э. атомов в осн. состоянии. Осн. <и наиб. точная часть этой информации получена при исследовании фотораспадаотрицат. ионов. В одном варианте этого метода отрицат. ионы разрушаютсяпод действием лазерного излучения данной длины волны, энергия связи электронаустанавливается по измерениям энергии освободившихся электронов. В др. <варианте данного метода для фоторазрушения отрицат. ионов используетсяизлучение перестраиваемого лазера, что позволяет определить положение порогафотораспада отрицат. иона, а по нему и энергию связи электрона. Фотоэлектронныйи лазерный методы определения энергии связи электрона в отрицат. ионе являютсяглавными и при исследовании молекулярных отрицат. ионов. В табл. указанкласс точности определения энергии С. к э.: О означает точность лучше 0,1%,1 -лучше 1%; 2 - лучше 3%; 3 - выше 10%; 4 - хуже 10%. Отрицат. ион Непостроен на метастабильном атоме Не. «Нет» в табл. означает, что стабильныйотрицат. ион данного элемента не образуется.
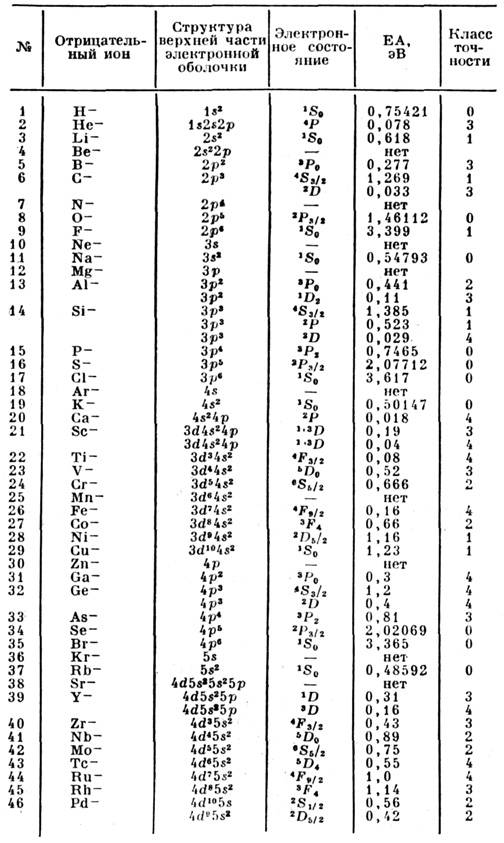
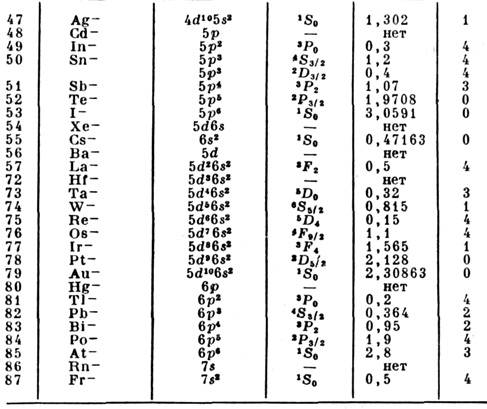
Величины ЕА молекул и радикалов колеблются в широких пределах. В рядеслучаев они составляют доли эВ, но для NO2 ЕА > 3 эВ, для ОНЕА
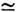 2 эВ, для CNЕА > 3 эВ.
2 эВ, для CNЕА > 3 эВ.Лит.; Таблицы физических величин. Справочник, под ред. И. К. Кикоина, <М., 1976; Радциг А. А., Смирнов Б. М., Параметры атомов и атомных ионов. <Справочник, М., 1986. Б. М. Смирнов.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
