- БОЙЛЯ ТОЧКА
- БОЙЛЯ ТОЧКА
-
точка минимума на изотерме реального газа в координатах p—pV (рис.; р — давление газа, V — занимаемый газом объём); названа в честь англ. учёного Р. Бойля (R. Boyle). Вблизи Б. т. небольшие участки изотерм реального газа можно приближённо рассматривать как отрезки горизонт. прямых, представляющих, согласно Клапейрона уравнению pV=(M/m)RT, изотермы идеального газа (R — газовая постоянная, М — масса газа, m — мол. масса). Иными словами, Б. т. определяет темп-ру, при к-рой для данного реального газа применимо ур-ние идеального газа. Участок изотермы аb (слева от Б. т.) соответствует условиям, когда реальный газ более сжимаем, чем идеальный; участок be (справа от Б. т.) соответствует условиям меньшей сжимаемости реального газа по сравнению с идеальным. Слева от Б. т. сказывается преобладающее влияние сил притяжения между молекулами, облегчающих сжатие газа, справа от Б. т.— влияние собств. объёма молекул, препятствующего сжатию. Вблизи Б. т. эти факторы, отличающие реальный газ от идеального, взаимно компенсируются.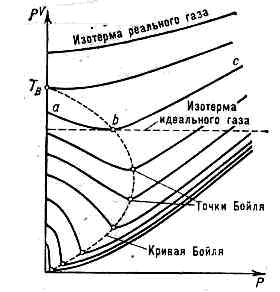 Изотермы реального газа в координатах р— pV. На изотермах с темп-рой T>TB точки Бойля отсутствуют.Линия, соединяющая Б. т. отд, изотерм, наз. кривой Бойля. Точка этой кривой, лежащая на оси ординат, определяет т. н. темп-ру Бойля ТB. Для газа, подчиняющегося Ван-дер-Ваальса уравнению, ТB=3,375 Тк, где Тк— критическая температура, При Т<Тk возможно полное сжижение газа под давлением, при Т<Тк возможно частичное сжижение газов при дросселировании (см. ДЖОУЛЯ — ТОМСОНА ЭФФЕКТ).
Изотермы реального газа в координатах р— pV. На изотермах с темп-рой T>TB точки Бойля отсутствуют.Линия, соединяющая Б. т. отд, изотерм, наз. кривой Бойля. Точка этой кривой, лежащая на оси ординат, определяет т. н. темп-ру Бойля ТB. Для газа, подчиняющегося Ван-дер-Ваальса уравнению, ТB=3,375 Тк, где Тк— критическая температура, При Т<Тk возможно полное сжижение газа под давлением, при Т<Тк возможно частичное сжижение газов при дросселировании (см. ДЖОУЛЯ — ТОМСОНА ЭФФЕКТ).
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
.
