- ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
-
один из двух осн. законов термодинамики, представляет собой закон сохранения энергии для систем, в к-рых существ. значение имеют тепловые процессы. П. н. т. было сформулировано в сер. 19 в. в результате работ нем. учёного Ю. Р. Майера, англ. физика Дж. П. Джоуля и нем. физика Г. Гельмгольца (см. ЭНЕРГИИ СОХРАНЕНИЯ ЗАКОН). Согласно П. н. т., термодинамич. система может совершать работу только за счёт своей внутр. энергии или к.-л. внеш. источников энергии. П. н. т. часто формулируют как невозможность существования вечного двигателя 1-го рода, к-рый совершал бы работу, не черпая энергию из к.-л. источника.При сообщении термодинамич. системе нек-рого кол-ва теплоты Q в общем случае изменяется её внутренняя энергия на DU и система совершает работу А:Q =DU+A. (1)Ур-ние (1), выражающее П. н. т., явл. определением изменения внутр. энергии системы (DU), т. к. Q и А — независимо измеряемые величины. Внутр. энергию системы DU можно, в частности, найти, измеряя работу системы в адиабатич. процессе (т. е. при Q=0): Aад =-DU, что определяет U с точностью до нек-рой аддитивной постоянной U0:U=DU+U0. (2)П. н. т. утверждает, что U явл. функцией состояния системы, т. е. каждое состояние термодинамич. системы характеризуется определ. значением U, независимо от того, каким путём система приведена в данное состояние (в то время как, значения Q и А зависят от процесса, приведшего к изменению состояния системы). При исследовании термодинамич. свойств физ. системы П. н. т. обычно применяется совместно со вторым началом термодинамики.
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
-
- законсохранения энергии для термодинамич. системы, согласно к-рому работа можетсовершаться только за счёт теплоты или к.-л. др. формы энергии. Поэтомуработу и кол-во теплоты можно измерять в одних единицах - Джоулях (1 Дж= 0,239 кал = 0,102 кгс/м). П. н. т. сформулировано как закон природы Ю. <Р. Майером (J. R. Мауег) в 1842 и установлено экспериментально Дж. Джоулем(J. Joule) в 1843. П. н. т. можно формулировать как невозможность существования вечногодвигателя1-го рода, к-рый совершал бы работу, не черпая энергию изк.-л. источника.
Согласно П. н. т., теплота Q, сообщаемаясистеме, равна сумме приращения внутр. энергии . и работы, производимойсистемой против внеш. сил:Q = U2-U1 + A; прибесконечно малом изменении состояния системы:

где
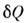 - бесконечно малое кол-во теплоты, передаваемой системе,
- бесконечно малое кол-во теплоты, передаваемой системе,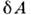 - работа, совершаемая системой против внеш. сил, dU - изменениееё внутр. энергии.
- работа, совершаемая системой против внеш. сил, dU - изменениееё внутр. энергии.
Ур-ние (1) является определением величины dU, т. к.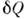 и
и 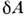 - независимоизмеряемые величины. П. н. т. утверждает, что dU есть полный дифференциалнек-рой ф-ции U (величины
- независимоизмеряемые величины. П. н. т. утверждает, что dU есть полный дифференциалнек-рой ф-ции U (величины 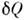 и
и 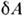 ,вообще говоря, не являются полными дифференциалами). Т. о., любая термодинамич. <система обладает ф-цией состояния - энергией U, зависящей лишь отпараметров, определяющих равновесное состояние системы, и не зависящейот процесса, к-рым система была приведена в это состояние. Передаваемоетепло Q и работа А зависят от пути, по к-рому совершаетсяпроцесс, т. к. величины
,вообще говоря, не являются полными дифференциалами). Т. о., любая термодинамич. <система обладает ф-цией состояния - энергией U, зависящей лишь отпараметров, определяющих равновесное состояние системы, и не зависящейот процесса, к-рым система была приведена в это состояние. Передаваемоетепло Q и работа А зависят от пути, по к-рому совершаетсяпроцесс, т. к. величины 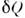 и
и 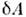 не есть полныедифференциалы. В системах, обменивающихся со средой веществом и энергией, <в П. н. т. следует учитывать энергию Z, передаваемую при переносемассы: Q= U2 - U1+ А+ Z.
не есть полныедифференциалы. В системах, обменивающихся со средой веществом и энергией, <в П. н. т. следует учитывать энергию Z, передаваемую при переносемассы: Q= U2 - U1+ А+ Z.
Энергию U можно экспериментальноопределить, измеряя работу, совершаемую адиабатически замкнутой термодинамич. <системой (т. е. при Q =0), тогда А ад= U2- U1, что определяет U с точностью до аддитивнойпостоянной. Работу А можно определить по изменениям параметров системы. <Напр., при бесконечно малом расширении однородной системы (жидкости илигаза) при давлении Р её работа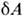 = PdV и, следовательно,
= PdV и, следовательно,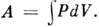 Ур-ние (1) в этом случае имеет вид
Ур-ние (1) в этом случае имеет вид 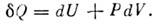
В общем случае, если система характеризуется . экстенсивными параметрами al, ..., а п иобобщёнными силами Х1, ..., Х п, элементарнаяработа
П. н. т. можно формулировать также с помощью энтальпииН= U+ PV, т . к.
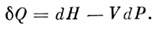
Такая форма удобна для применения П. н. <т. к стационарным процессам (см. Джоуля - Томсчна эффект). П. н. <т. имеет многочисленные приложения, особенно эффективные при использованиитакже и второго начала термодинамики. Следствием П. н. т. являетсяформула Майера для разности между теплоёмкостью при постоянном давлениии при постоянном объёме:
Ср- СV = [.+(dU/dV)T](dV/dT)P,
эта величина означает кол-во тепла, перешедшеев работу.
В феноменологич. термодинамике внутр. <энергию U = U(V,T )рассматривают как экспериментально измеряемуюф-цию (калорическое уравнение состояния). Статистич. физика позволяет теоретическирассчитать ур-ние состояния исходя из законов взаимодействия между молекуламии вывести соотношение (2). При этом одновременно получается статистич. <обоснование как П. н. т., так и 2-го начала термодинамики.Лит.: Ван-дер-Ваальс И. Д., КонстаммФ., Курс термостатики, [пер. с нем.], ч. 1, М., 1936; Эпштейн П. С., Курстермодинамики, пер. с англ., М. - Л., 1948; Зоммерфельд А., Термодинамикаи статистическая физика, пер. с нем., М., 1955; Кубо Р., Термодинамика, <пер. с англ., М., 1970; Леонтович М. А., Введение в термодинамику. Статистическаяфизика, М., 1983; Новиков П. И., Термодинамика, М., 1984.
Д. Н. Зубарев.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
