- ПАРАМЕТРЫ СОСТОЯНИЯ
- ПАРАМЕТРЫ СОСТОЯНИЯ
-
(термодинамические параметры), физ. величины, характеризующие состояние термодинамич. системы: темп-pa, давление, уд. объём, намагниченность, электрич. поляризация и др. Различают э к с т е н с и в н ы е П. с., пропорц. массе системы, и и н т е н с и в н ы е П. с., не зависящие от массы системы. К экстенсивным П. с. относятся объём, внутренняя энергия, энтропия, энтальпия, Гиббса энергия, Гельмгольца энергия (свободная энергия), к интенсивным — давление, темп-pa, концентрация, магн. индукция и др. Не все П. с. независимы, так что равновесное состояние системы можно однозначно определить, установив значения огранич. числа П. с. (см. УРАВНЕНИЕ СОСТОЯНИЯ, ГИББСА ПРАВИЛО ФАЗ).
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- ПАРАМЕТРЫ СОСТОЯНИЯ
-
(термодинамическиепараметры) - физ. величины, характеризующие равновесное состояние термодинамич. <системы: темп-pa, объём, плотность, давление, намагниченность, электрич. <поляризация и др. Различают экстенсивные П. с., пропорциональные объёму(или массе) системы ( внутренняя энергия U, энтропия S, энтальпия Н, Гельмголъцаэнергия, или свободная энергия F, Гиббса энергия G), и интенсивныеП. с., не зависящие от массы системы (темп-pa Т, давление Р,концептрация с, хим. потенциал
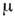 ).В состоянии термодинамич. равновесия П. с. не зависят от времени и пространств. <координат. В неравновесном (квазиравновесном) состоянии П. с. могут зависетьот координат и времени.
).В состоянии термодинамич. равновесия П. с. не зависят от времени и пространств. <координат. В неравновесном (квазиравновесном) состоянии П. с. могут зависетьот координат и времени.
Термодииамич. состояние определяется заданиемсовокупности независимых П. с. Однако не все П. с. являются независимыми. Уравнениесостояния выражает зависимые П. с. через независимые; напр., давлениеявляется ф-цией темп-ры и объёма Р = P(V, Т). Объём является внешнимП. с., т. к. определяется положением внеш. тел (стенки сосуда, положениепоршня). Темп-pa зависит только от внутр. состояния системы и наз. внутреннимП. с. В общем случае Р= Р(а1,..., а п, Т), где а i - внеш. П. с.
Элементарная работа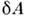 термодинамич. системы определяется П. с., напр. для жидкости или газа
термодинамич. системы определяется П. с., напр. для жидкости или газа 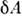 = PdV, а в общем случае
= PdV, а в общем случае 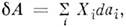 где Х i = Х i (а1,..., а п, Т) - обобщённые силы, являющиеся также П. с. Каждому набору независимыхП. с. соответствуют определ. потенциалы термодинамические (характеристическиефункции), определяющие все термодинамич. свойства системы и зависящиелишь от выбранных параметров; напр., внутр. энергия U = U(V, S), энтропия S = S(V, U), энтальпия H = Н(Р, S), энергия Гельмгольца(свободная энергия F = F(V, Т), энергия Гиббса G= G(P,T, N), N - число частиц. Для многокомпонентных систем нужно учитыватьещё дополнит. П. с.: концентрации компонент с i или иххим. потенциалы
где Х i = Х i (а1,..., а п, Т) - обобщённые силы, являющиеся также П. с. Каждому набору независимыхП. с. соответствуют определ. потенциалы термодинамические (характеристическиефункции), определяющие все термодинамич. свойства системы и зависящиелишь от выбранных параметров; напр., внутр. энергия U = U(V, S), энтропия S = S(V, U), энтальпия H = Н(Р, S), энергия Гельмгольца(свободная энергия F = F(V, Т), энергия Гиббса G= G(P,T, N), N - число частиц. Для многокомпонентных систем нужно учитыватьещё дополнит. П. с.: концентрации компонент с i или иххим. потенциалы  .Для многофазных систем каждая фаза описывается своим парциальным термодинамич. <потенциалом (см. Гиббса правило фаз).
.Для многофазных систем каждая фаза описывается своим парциальным термодинамич. <потенциалом (см. Гиббса правило фаз).Д. Н. Зубарев.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
