- КРИТИЧЕСКОЕ СОСТОЯНИЕ
- КРИТИЧЕСКОЕ СОСТОЯНИЕ
-
предельное состояние равновесия двухфазной системы, в к-ром обе сосуществующие фазы становятся тождественными по своим св-вам. На диаграммах состояния К. с. соответствуют предельные точки на кривых равновесия фаз — т. н. критические точки. Согласно Гиббса правилу фаз, критич. точка изолирована в случае двухфазного равновесия чистого в-ва, а в случае, напр., бинарных (двухкомпонентных) р-ров критич. точки образуют критич. кривую (см. рис. в ст. (см. КРИТИЧЕСКАЯ ТЕМПЕРАТУРА)). Значения параметров состояния системы, соответствующие К. с., наз. критическими — критич. давление рк, критич. темп-pa Тк, критич. объём VК, критич. концентрация хк и т. д.С приближением к К. с. различия в плотности, составе и др. св-вах сосуществующих фаз, а также теплота фазового перехода и межфазное поверхностное натяжение уменьшаются и в критич. точке равны нулю.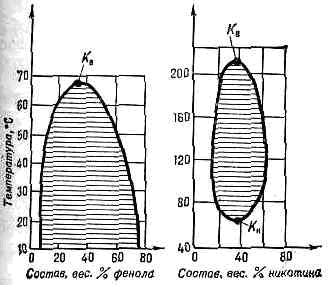 Слева — верхняя критич. точка (Кв) .кидкой смеси фенол — вода (с TК»66°С), заштрихована область, где смесь состоит из тух фаз, имеющих разл. концентрацию комитентов; справа — двухкомпонентная жидкая система никотин — вода, имеющая как верхнюю критич. точку растворения Kв с Tк»481 К (208 °С), так и нижнюю критич. точку Kн с Tк»334 К (61°С).Значительно возрастают флуктуации плотности и концентрации (в смесях). Эти особенности в структуре в-в и их св-вах приводят к наблюдаемым в . с. критическим явлениям. В двухкомпонентных системах характерные |я К. с. явления наблюдаются не только в критич. точке равновесия жидкость — газ, но и в т. .н. критич. точках растворимости, где взаимная растворимость компонентов становится неограниченной. Существуют двойные жидкие системы как с одной критич. точкой растворимости, так и с двумя — верхней и нижней (рис.). Эти точки явл. температурными границами области расслаивания жидких смесей на фазы разл. состава. Аналогичной способностью к расслаиванию при определённой критич. темп-ре обладают нек-рые р-ры газов и тв. р-ры. Переход системы из однофазного состояния в двухфазное вне критич. точки и изменение состояния в самой критич. точке существенно различаются. В первом случае при расслаивании на две фазы переход начинается с появления" небольшого кол-ва (зародыша) 2-й фазы с конечным отличием её св-в от св-в 1-й фазы, что сопровождается выделением или поглощением теплоты фазового перехода. Поскольку возникновение зародыша новой фазы приводит к появлению поверхности раздела фаз и поверхностной энергии, для его рождения требуются определённые энергетич. затраты. Это означает, что такой фазовый переход (фазовый переход I рода) может начаться лишь при нек-ром переохлаждении (перегреве) в-ва, способствующем появлению устойчивых зародышей новой фазы.Фазовый переход в критич. точке (предельной на кривой равновесия фаз) имеет много общего с фазовым переходом II рода. В критич. точке фазовый переход происходит в масштабах всей системы. Флуктуационно возникающая новая фаза по своим св-вам бесконечно мало отличается от св-в исходной фазы. Поэтому возникновение новой фазы не связано с поверхностной энергией, т. е. исключается перегрев (или переохлаждение) и фазовый переход не сопровождается выделением или поглощением теплоты, что характерно для фазовых переходов II рода. Знание св-в в-в в К. с. (см. КРИТИЧЕСКИЕ ЯВЛЕНИЯ) необходимо во мн. областях науки и техники: при создании энергетич. установок на сверхкритич. параметрах, установок для сжижения газов, разделения смесей и т. д.
Слева — верхняя критич. точка (Кв) .кидкой смеси фенол — вода (с TК»66°С), заштрихована область, где смесь состоит из тух фаз, имеющих разл. концентрацию комитентов; справа — двухкомпонентная жидкая система никотин — вода, имеющая как верхнюю критич. точку растворения Kв с Tк»481 К (208 °С), так и нижнюю критич. точку Kн с Tк»334 К (61°С).Значительно возрастают флуктуации плотности и концентрации (в смесях). Эти особенности в структуре в-в и их св-вах приводят к наблюдаемым в . с. критическим явлениям. В двухкомпонентных системах характерные |я К. с. явления наблюдаются не только в критич. точке равновесия жидкость — газ, но и в т. .н. критич. точках растворимости, где взаимная растворимость компонентов становится неограниченной. Существуют двойные жидкие системы как с одной критич. точкой растворимости, так и с двумя — верхней и нижней (рис.). Эти точки явл. температурными границами области расслаивания жидких смесей на фазы разл. состава. Аналогичной способностью к расслаиванию при определённой критич. темп-ре обладают нек-рые р-ры газов и тв. р-ры. Переход системы из однофазного состояния в двухфазное вне критич. точки и изменение состояния в самой критич. точке существенно различаются. В первом случае при расслаивании на две фазы переход начинается с появления" небольшого кол-ва (зародыша) 2-й фазы с конечным отличием её св-в от св-в 1-й фазы, что сопровождается выделением или поглощением теплоты фазового перехода. Поскольку возникновение зародыша новой фазы приводит к появлению поверхности раздела фаз и поверхностной энергии, для его рождения требуются определённые энергетич. затраты. Это означает, что такой фазовый переход (фазовый переход I рода) может начаться лишь при нек-ром переохлаждении (перегреве) в-ва, способствующем появлению устойчивых зародышей новой фазы.Фазовый переход в критич. точке (предельной на кривой равновесия фаз) имеет много общего с фазовым переходом II рода. В критич. точке фазовый переход происходит в масштабах всей системы. Флуктуационно возникающая новая фаза по своим св-вам бесконечно мало отличается от св-в исходной фазы. Поэтому возникновение новой фазы не связано с поверхностной энергией, т. е. исключается перегрев (или переохлаждение) и фазовый переход не сопровождается выделением или поглощением теплоты, что характерно для фазовых переходов II рода. Знание св-в в-в в К. с. (см. КРИТИЧЕСКИЕ ЯВЛЕНИЯ) необходимо во мн. областях науки и техники: при создании энергетич. установок на сверхкритич. параметрах, установок для сжижения газов, разделения смесей и т. д.
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
.
