- ГАЗЫ
в-ва в агрегатном состоянии, характеризующемся слабым взаимод. составляющих в-во частиц (по сравнению с их средней кинетич. энергией), в результате чего Г. заполняют весь предоставленный им объем. Г., как и нормальные (обычные) жидкости, макроскопически однородны и изотропны при отсутствии внеш. воздействий, в отличие от анизотропных состояний в-ва - твердого кристаллического и жидких кристаллов. Строго различать жидкое и газообразное состояния в-ва на фазовой диаграмме можно лишь при т-ре ниже критической Г кр (см. рис.), т. к. выше Т кр газ нельзя превратить в жидкость повышением давления. Ниже Ткр возможно фазовое равновесие жидкость Ч пар, причем газообразному состоянию отвечает фаза с меньшей плотностью (Г., находящийся в термодинамич. равновесии с жидкой или твердой фазой того же в-ва, обычно наз. паром). В критич. точке различие между жидкостью и паром исчезает, поэтому возможен непрерывный (без фазового превращения) переход из газообразного состояния в жидкое. При этом все св-ва в-ва меняются постепенно (наиб, быстро вблизи критич. точки). В тройной точке Т^ сосуществуют газ, жидкость и твердое тело (кристалл), причем плотность Г. вблизи тройной точки обычно на три порядка меньше плотности жидкости или кристалла. Кривую сосуществования жидкости и Г. наз. кривой парообразования, твердого тела и Г.-кривой сублимации (возгонки).
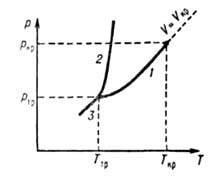
Диаграмма состояния однокомпонентной системы в координатах давление р-темпера-тура Т! Линии /, 2 и 3-кривые парообразования, плавления и возгонки соотв.; 7" кр и р кр -координаты критич. точки; Т тр и р тр -координаты тройной точки; И, Ч-Критич. объем>.
В нормальных условиях (при 0
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
