- ВАНАДАТЫ
- соли ванадиевых к-т. Различают : В.(V) - соли не существующих в своб. состоянии или малоустойчивых к-т -ортованадиевой H3VO4, пированадиевой H4V2O7, метаванадиевой HVO3, декаванадиевой H6V10O28, додекаванадиевой H2V12O31 и др. по ли ванадиевых к-т; В.(IV)-соли не существующих в своб. состоянии к-т - Н 2V4 О 9, H4V2O6 и др. [устаревшие назв. В.(IV) - ванадиты, гипованадаты]. Существуют также гидроксованадаты, гидрованадаты и В. с анионами др. к-т, напр. соед. со структурой апатита Ca5(VO4)3CO3. Известны двойные и тройные В., в частности ортованадаты со структурой гранатов, напр. Na3Cr2V3012, LiCa2Mg2V3012.
В состав анионов B.(V) входят изолированные или связанные ванадийкислородные группировки. Структура метаванадатов щелочных металлов цепочечная, построена из тетраэдпов VО 4, связанных общими вершинами. Пированадаты М 4V2 О 7 построены из группировок V2 О 7 (два сочлененных вершинами тетраэдра VО 4). Декаванадаты состоят из плотноупакованных октаэдров VO6.
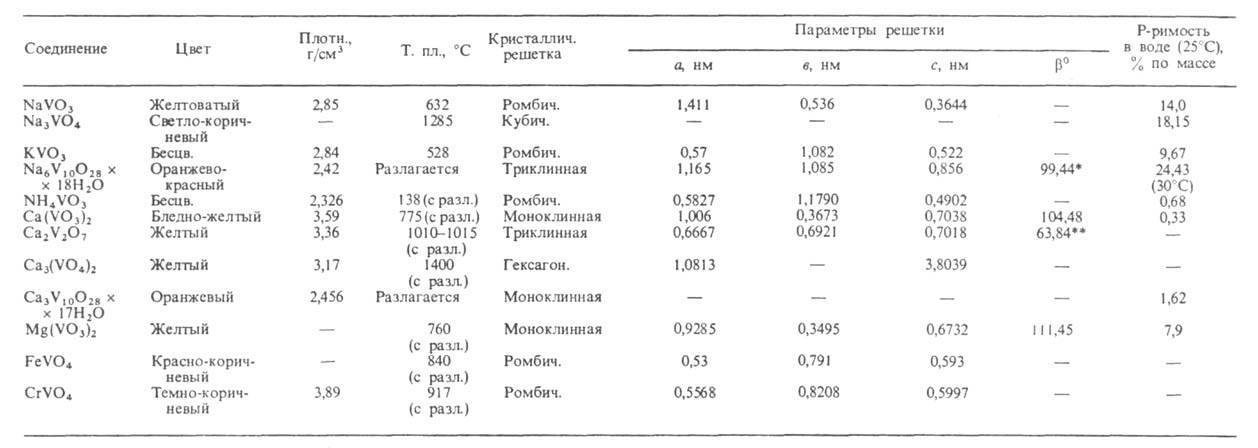
Св-ва важнейших B.(V) представлены в таблице. Т-ры плавления безводных В. повышаются при переходе от мета- к пиро- и ортованадатам. наиб. р-римостью в воде обладают В. щелочных металлов. Соли Са и тяжелых металлов обычно малорастворимы. Р-римость В. уменьшается от дека- к ортованадатам. Очень многие В. раств. инконгруэнтно. В водных р-рах в зависимости от рН и концентрации ванадатов м. б. устойчивы разл. ванадатионы (см. рис.). В соответствии с этим из водных р-ров осаждаются В. разл. состава, обычно гидратированные. Полное обезвоживание кристаллогидратов дека- и др. поливанадатов сопровождается их разложением до оксидов металлов и соед. типа ванадиевых бронз (см. Бронзы оксидные). При добавлении Н 2 О 2 к р-рам В. щелочных металлов в щелочных и слабокислых средах образуются моно- и дипероксованадат-ионы - [VO3(O2)]3 ~ и [VO2(O2)2]3-, окрашивающие р-р в желтый цвет, в сильнокислых средах -ионы [V(O2)]3+ , вызывающие коричнево-красное окрашивание. B.(V) окрашивают многие орг. соед. - резорцин, стрихнин, фенол, анилин и др.
СВОЙСТВА ВАНАДАТОВ(V)
<*
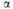 = 101,23
= 101,23
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
