- ХРОНОАМПЕРОМЕТРИЯ
электрохим. метод исследования и анализа, основанный на изучении зависимости от времени величины тока, протекающего через электролитич. ячейку при определенном значении электродного потенциала поляризуемого электрода. Этот потенциал можно поддерживать, напр., с помощью потенциостата. Напряжение, накладываемое на электролитич. ячейку, измеряют с учетом омич. падения напряжения в ней и приборе, регистрирующем ток. Обычно используют трехэлектродную ячейку, включающую, кроме поляризуемого рабочего (индикаторного) и вспомогательного электродов (через к-рые протекает электрич. ток), электрод сравнения, необходимый для контроля потенциала рабочего электрода. Двухэлектррдная ячейка применяется в тех редких случаях, когда не нужно поддерживать строго постоянный потенциал рабочего электрода. Электрохим. процесс (электролиз) проводят в течение сравнительно короткого времени (от неск. секунд до неск. минут) на рабочем стационарном электроде (напр., платиновом, графитовом, ртутном) в неперемешиваемом р-ре, содержащем настолько большой избыток фонового электролита, что ионная сила р-ра практически не зависит от концентрации исследуемого электрохимически активного (электроактивного) в-ва. Электрод сравнения (насыщ. каломельный или хлорсеребряный) остается во время измерения неполяризуемым, т. е. его потенциал сохраняет постоянное значение независимо от малых значений тока, проходящего через ячейку. Вспомогат. электрод изготавливают обычно из платины или графитовых материалов. Величина тока в X. определяется скоростью гл. обр. диффузионного переноса в-в, участвующих в электродном процессе, и(или) кинетикой электрохим. р-ции. Если электрохим. р-ция протекает настолько быстро, что на электродах достигается электрохим. равновесие, то процессы обратимы, и скоростьлимитирующей стадией является диффузия. Тогда для вычисления электродного потенциала применимо Нернста уравнение. Если электроактивное в-во (со стандартным электродным потенциалом Е 0) восстанавливается, то при менее отрицат. потенциале, чем Е 0, электрохим. р-ция не происходит и ток практически равен 0. Сдвиг потенциала к более отрицат. значениям приводит к увеличению равновесной концентрации восстановленной формы, ток возрастает и достигает предельной величины, определяемой диффузией электроактивного в-ва. Зависимость плотности предельного тока i от объемной концентрации Сокисленной формы электроактивного в-ва описывается ур-нием Коттреля: i=
 где п - число электронов, участвующих в электродном процессе; F - число Фарадея; D - коэф. диффузии окисленной формы электроактивного в-ва; t - время. Скорость диффузии зависит гл. обр. от геометрии пов-сти раздела электрод - раствор. Если рабочий электрод имеет форму пластинки или цилиндра, то в процессе электролиза при достаточно отрицательном потенциале плотность тока в течение времени падает до 0 (причем в случае цилиндрич. электрода ток падает значительно медленнее, чем в случае плоского). При использовании электрода сферич. формы значение тока уменьшается до нек-рой постоянной, отличной от 0 величины. При использовании плоских перемещающихся в р-ре электродов величина предельного тока возрастает в 7/3 раза; при этом с помощью ур-ния Коттреля можно вычислить значения мгновенного диффузионного тока (см. Вольтамперометрия).
где п - число электронов, участвующих в электродном процессе; F - число Фарадея; D - коэф. диффузии окисленной формы электроактивного в-ва; t - время. Скорость диффузии зависит гл. обр. от геометрии пов-сти раздела электрод - раствор. Если рабочий электрод имеет форму пластинки или цилиндра, то в процессе электролиза при достаточно отрицательном потенциале плотность тока в течение времени падает до 0 (причем в случае цилиндрич. электрода ток падает значительно медленнее, чем в случае плоского). При использовании электрода сферич. формы значение тока уменьшается до нек-рой постоянной, отличной от 0 величины. При использовании плоских перемещающихся в р-ре электродов величина предельного тока возрастает в 7/3 раза; при этом с помощью ур-ния Коттреля можно вычислить значения мгновенного диффузионного тока (см. Вольтамперометрия).
Если электродные процессы необратимы и лимитирующей стадией является электрохим. р-ция, зависимость плотности тока от концентрации электроактивного в-ва описывается ур-нием: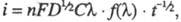 где
где 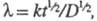 k - константа скорости прямой электрохим. р-ции, а ф-ция f зависит от
k - константа скорости прямой электрохим. р-ции, а ф-ция f зависит от 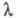 и изменяется от 1 до 0. Тогда, при t= 0 ток имеет конечную величину. В случае сферич. электрода с большим радиусом при t
и изменяется от 1 до 0. Тогда, при t= 0 ток имеет конечную величину. В случае сферич. электрода с большим радиусом при t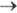 0 зависимость тока от времени такая же, как в случае плоского электрода.
0 зависимость тока от времени такая же, как в случае плоского электрода.
Если электродным процессам предшествует хим. р-ция первого порядка, в результате к-рой образуется электроактивное в-во, зависимость i от tи Стакая же, как для необратимых электродных процессов, но дополнительно учитывают параметр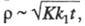 где К - константа равновесия хим. р-ции; k1 - константа скорости прямой хим. р-ции.
где К - константа равновесия хим. р-ции; k1 - константа скорости прямой хим. р-ции.
В случае каталитич. электродных процессов (см. Полярография )отношение каталитич. тока к предельному диффузионному току пропорционально параметру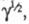 зависящему от k1, С и t. Если между двумя электрохим. процессами протекает хим. р-ция, то при малой скорости последней (k1
зависящему от k1, С и t. Если между двумя электрохим. процессами протекает хим. р-ция, то при малой скорости последней (k1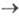 0) зависимость i от tи Сописывается ур-нием Коттреля; если
0) зависимость i от tи Сописывается ур-нием Коттреля; если 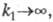 то в ур-нии Коттреля ппредставляет собой число электронов, участвующих в обеих электрохим. р-циях.
то в ур-нии Коттреля ппредставляет собой число электронов, участвующих в обеих электрохим. р-циях.
X. используется гл. обр. для изучения кинетики электродных р-ций, для определения кол-ва электричества при электролизе. В аналит. практике X. применяют редко, т. к. по своим метрологич. характеристикам метод уступает вольтамперометрии.Лит.: Галюс 3., Теоретические основы электрохимического анализа, пер. с польск., М., 1974; Бонд А. М., Полярографические методы в аналитической химии, пер. с англ., М., 1983.
А И. Каменев.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
