- ФИБРИН
белок, образующийся из фибриногена под действием фермента тромбина; конечный продукт свертывания крови, структурная основа тромба.
Предшественник Ф. (фибриноген)- гликопротеин (мол. м. 340 тыс.), содержащий две одинаковые субъединицы, каждая из к-рых состоит из трех разл. полипептидных цепей А
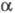 (мол. м. 67 тыс.), В
(мол. м. 67 тыс.), В 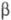 (мол. м. 56 тыс.) и
(мол. м. 56 тыс.) и 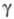 (47 тыс.); ф-ла фибриногена (А
(47 тыс.); ф-ла фибриногена (А 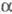 , В
, В 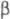 ,
, 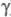 )2 (А и В - N-концевые последовательности соотв.
)2 (А и В - N-концевые последовательности соотв. 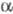 - и
- и 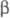 -цепей, к-рые наз. фибринопептидами А и В).
-цепей, к-рые наз. фибринопептидами А и В).
В молекуле фибриногена находится 24 связи S-S, три из к-рых связывают 6 полипептидных цепей в N-концевых областях, формируя центральный, или E-домен. Два идентичных крайних D-домена включают С-концевые области
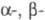 и
и 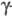 -цепей (молекула имеет форму гантели).
-цепей (молекула имеет форму гантели).
Переход фибриногена в Ф. происходит по схеме:

Активация перехода фибриногена в Ф. происходит в Е-до-мене, в N-концевых областях А
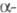 и В
и В 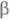 -цепей. Она начинается с гидролиза тромбином пептидных связей, образованных Arg-15 и GIy-16 в
-цепей. Она начинается с гидролиза тромбином пептидных связей, образованных Arg-15 и GIy-16 в 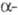 цепи (букв. обозначения см. в ст. Аминокислоты). При этом высвобождаются две молекулы фибри-нопептида А и формируются два участка полимеризации, к-рые спонтанно взаимод. с комплементарными центрами полимеризации, расположенными в С-концевых областях D-доменов двух др. молекул. Нековалентное межмол. взаимод. между E- и D-доменами ведет к образованию двухнитча-того полимера.
цепи (букв. обозначения см. в ст. Аминокислоты). При этом высвобождаются две молекулы фибри-нопептида А и формируются два участка полимеризации, к-рые спонтанно взаимод. с комплементарными центрами полимеризации, расположенными в С-концевых областях D-доменов двух др. молекул. Нековалентное межмол. взаимод. между E- и D-доменами ведет к образованию двухнитча-того полимера.
След. этап активации - отщепление двух молекул фибри-нопептида В в результате гидролиза тромбином пептидной связи между остатками Arg-14 и GIy-15 в
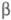 -цепи, в результате чего формируются два дополнит, участка полимеризации в E-домене фибрин-мономера, комплементарных двум центрам в D-доменах. Скорость отщепления фибринопептидов В увеличивается в процессе полимеризации фибрин-мономеров. Растущие изначально только в длину протофибриллы Ф. начинают утолщаться и ветвиться. Фибриллы ассоциируются латерально, превращаясь в толстые, скрученные наподобие спирали волокна трехмерной сети фибринового сгустка.
-цепи, в результате чего формируются два дополнит, участка полимеризации в E-домене фибрин-мономера, комплементарных двум центрам в D-доменах. Скорость отщепления фибринопептидов В увеличивается в процессе полимеризации фибрин-мономеров. Растущие изначально только в длину протофибриллы Ф. начинают утолщаться и ветвиться. Фибриллы ассоциируются латерально, превращаясь в толстые, скрученные наподобие спирали волокна трехмерной сети фибринового сгустка.
Структура фибринового сгустка стабилизируется транспеп-тидазой, или фактором ХШа, к-рый в присут. Ca2+ катализирует образование поперечных "сшивок" между антипараллельными
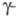 цепями путем образования ковалентных изопеп-тидных связей между Gln-398 одной цепи и Lys-406 другой (в результате р-ции трансамидирования). В последующем образуются изопептидные связи между
цепями путем образования ковалентных изопеп-тидных связей между Gln-398 одной цепи и Lys-406 другой (в результате р-ции трансамидирования). В последующем образуются изопептидные связи между 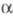 -цепями, в к-рых участвуют остатки Gln-328 и Lys-518, а также Gln-366 и Lys-584 с образованием
-цепями, в к-рых участвуют остатки Gln-328 и Lys-518, а также Gln-366 и Lys-584 с образованием 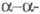 мультимеров, что обусловливает латеральный рост фибриновых волокон.
мультимеров, что обусловливает латеральный рост фибриновых волокон.
От структуры фибринового сгустка и степени его стабилизации зависят мех. св-ва сгустка, такие, как эластичность и прочность. Это важно для выполнения им гемостатич. ф-ций, поскольку он является основой гемостатич. тромба, препятствующего истечению крови из сосудов при нарушении их целостности при разл. рода повреждениях. Генетич. аномалии молекулы фибриногена и низкая концентрация фактора ХШа в крови приводят к ненормальной полимеризации и образованию фибринового сгустка с нарушенными физ. св-вами, что ведет к ряду патологич. состояний, сопровождающихся кровоточивостью или тромботич. осложнениями у больных.
Ф. является также прир. субстратом плазмина, к-рый регулирует процесс фибринолиза, приводящий к растворению фибриновых сгустков и тромбов. Высокое сродство Ф. к предшественнику плазмина (плазминогену) и его тканевому активатору обеспечивает возможность образования плазмина непосредственно на пов-сти полимерного фибрина, или тромба.
Лит.: Овчинников Ю. А., Биоорганическая химия, M., 1987, с. 234-36; Медведь Л. В., Литвинович СВ., "Биохимия животных и человека", 1989, № 13, с. 18-27; Позднякова T. M., там же, с. 27-36.
И. П. Баскова.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
