- ПАЛЛАДИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
, содержат связь PdЧС. Связь Pd с орг. лигандом может осуществляться по
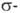 и
и 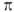 -типу (соотв.
-типу (соотв. 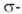 и
и 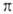 -комплексы). Формальная степень окисления Pd в П. с. прсим. +2, реже 0 и в нек-рых биядерных комплексах +1. Физ. и хим. св-ва П. с. зависят от типа П. с., степени окисления Pd и присутствия др. лигандов.
-комплексы). Формальная степень окисления Pd в П. с. прсим. +2, реже 0 и в нек-рых биядерных комплексах +1. Физ. и хим. св-ва П. с. зависят от типа П. с., степени окисления Pd и присутствия др. лигандов.
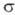 -Комплексы. Для соед. Pd с
-Комплексы. Для соед. Pd с 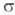 -связью PdЧС характерны комплексы [PdX(R)L2] и [Pd(R2)L2] (R-Alk, Ar, алкенил, ацил, алкинил; L-донорный лиганд, преим. третичный фосфин; Х-Сl, Вг и др.), молекулы к-рых имеют строение плоского квадрата. Осн. хим. р-ции а-комплсксов: 1) термич. разложение соед. типа [Pd(R2)L2] (R = СН 3, С 2 Н 5, С 3 Н 7) с образованием углеводородов RЧR или олефинов (при R
-связью PdЧС характерны комплексы [PdX(R)L2] и [Pd(R2)L2] (R-Alk, Ar, алкенил, ацил, алкинил; L-донорный лиганд, преим. третичный фосфин; Х-Сl, Вг и др.), молекулы к-рых имеют строение плоского квадрата. Осн. хим. р-ции а-комплсксов: 1) термич. разложение соед. типа [Pd(R2)L2] (R = СН 3, С 2 Н 5, С 3 Н 7) с образованием углеводородов RЧR или олефинов (при R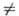 СН 3); 2) расщепление связи PdЧС при действии к-т, галогенов, окислителей, комплексных гидридов металлов; 3) р-ции внедрения лигандов по связи PdЧС (важны в каталитич. р-циях образования связи СЧС); 4) легкое замещение лигандов X, находящихся в транс-положении к R в П. с. типа [PdX(R)L2], напр.:
СН 3); 2) расщепление связи PdЧС при действии к-т, галогенов, окислителей, комплексных гидридов металлов; 3) р-ции внедрения лигандов по связи PdЧС (важны в каталитич. р-циях образования связи СЧС); 4) легкое замещение лигандов X, находящихся в транс-положении к R в П. с. типа [PdX(R)L2], напр.:
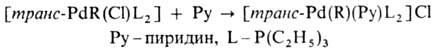
Способы получения s-комплексов: 1) взаимод. солей и комплексов Pd с орг. соед. металлов (Mg, Li, Hg, Al, Tl и др.), напр.:
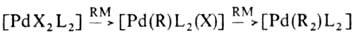
2) окисли. присоединение орг. галогенидов к комплексам Pd(0): [PdL4] + RX
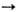 [PdX(R)L2]; 3) взаимод. комплексов Pd(0) с соед., содержащими поляризованную связь C=Y (Y = О, S), напр.:
[PdX(R)L2]; 3) взаимод. комплексов Pd(0) с соед., содержащими поляризованную связь C=Y (Y = О, S), напр.:
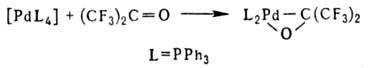
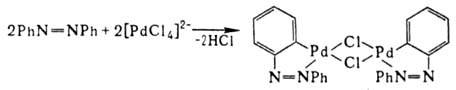
3) особый случай образования
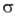 -связи PdЧС-р-ции цикло-металлирования, напр.:
-связи PdЧС-р-ции цикло-металлирования, напр.:
 -Комплексы. Наиб. многочисленны и хорошо изучены
-Комплексы. Наиб. многочисленны и хорошо изучены
 -аллильные комплексы, к-рые обладают относит, устойчивостью и доступностью. Большинство комплексов относят к димерам типа [PdCl(
-аллильные комплексы, к-рые обладают относит, устойчивостью и доступностью. Большинство комплексов относят к димерам типа [PdCl( -аллил)]2 с
-аллил)]2 с 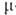 -галогеновыми мостиками. Основные хим. р-ции комплексов: 1) обмен атома Сl на др. лиганды; р-ции могут протекать с сохранением димерной структуры (напр., при замене на Вг или I) или с разрывом галогеновых мостиков (напр., при действии циклопентадиенидов и ацетилацетонатов Na или Тl, фосфи-нов и др. подобных реагентов); в последнем случае образуются мономерные комплексы [Pd(
-галогеновыми мостиками. Основные хим. р-ции комплексов: 1) обмен атома Сl на др. лиганды; р-ции могут протекать с сохранением димерной структуры (напр., при замене на Вг или I) или с разрывом галогеновых мостиков (напр., при действии циклопентадиенидов и ацетилацетонатов Na или Тl, фосфи-нов и др. подобных реагентов); в последнем случае образуются мономерные комплексы [Pd(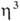 -аллил) (
-аллил) (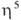 -С 5 Н 5)], [Pd(
-С 5 Н 5)], [Pd(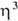 -аллил) асас]( асас - ацетилацетонат анион); 2) разрыв связи PdЧаллил при окислении с образованием ненасыщ. карбонильных соед., при восстановлении с образованием моноолефинов и насыщ. соед., а также при действии галогенов, оснований и др.; 3) р-ции переноса аллильного ли-ганда на др. металлы, напр.:
-аллил) асас]( асас - ацетилацетонат анион); 2) разрыв связи PdЧаллил при окислении с образованием ненасыщ. карбонильных соед., при восстановлении с образованием моноолефинов и насыщ. соед., а также при действии галогенов, оснований и др.; 3) р-ции переноса аллильного ли-ганда на др. металлы, напр.:
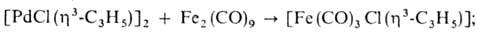
4) в присут. донорных лигандов или при повыш. т-ре мн. аллильные комплексы Pd претерпевают динамич. перегруппировки, включающие
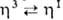 -переходы аллильного ли-ганда.
-переходы аллильного ли-ганда.
Способы получения
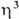 -аллильных комплексов: 1) р-ции олефинов с PdCl2 или Na2PdCl4 в уксусной к-те разл. концентрации, иногда в присут. оснований, промежуточно образуются
-аллильных комплексов: 1) р-ции олефинов с PdCl2 или Na2PdCl4 в уксусной к-те разл. концентрации, иногда в присут. оснований, промежуточно образуются 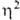 -олефиновые комплексы (см. ниже); побочные продукты - насыщ. и ненасыщ. альдегиды и кетоны; 2) взаимод. соед. Pd(II) с 1,3- и 1,2-диенами, замещенными циклопропанами, аллилгалогснидами и родственными соед., с аллильными соед. др. металлов и т. п., напр.:
-олефиновые комплексы (см. ниже); побочные продукты - насыщ. и ненасыщ. альдегиды и кетоны; 2) взаимод. соед. Pd(II) с 1,3- и 1,2-диенами, замещенными циклопропанами, аллилгалогснидами и родственными соед., с аллильными соед. др. металлов и т. п., напр.:
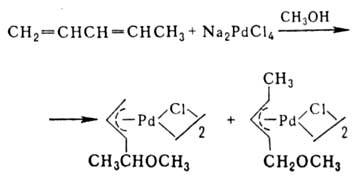
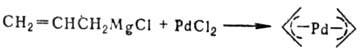
h2 -Олефиновые комплексы известны для Pd(II) типа [PdCl2(h2 -олефин)]2 и Pd(0) типа [РdL2(h2 -олефин)], где L = PPh3. Комплексы Pd(II) присоединяют нуклеофилы к олефиновому лиганду с восстановлением Pd(II) до Pd(0), напр.:
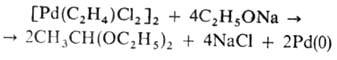
Подобные р-ции лежат в основе пром. способов получения винилацетата и ацетальдегида из этилена. Получают олефи-новые комплексы Pd(II) замещением на олефины др. лиган-дов, напр.: [PdCl2(NCPh)2] + олефин
 [PdСl2(h2 -олефин)]2, а также прямым взаимод. PdCl2 с олефинами, напр. с изобутеном, стиролом, циклогексеном и др. Образующиеся h2 -олефиновые комплексы обычно неустойчивы и в зависимости от строения олефина и условий р-ции превращ. в h3 -аллильные комплексы с отщеплением НСl или дают продукты окисления олефинов (альдегиды или кетоны) при взаимод. с водой. h2 -Олефиновые комплексы Pd(0) получены с олефинами, имеющими электроноакцепторные заместители, напр. с производными малеиновой и фумаровой к-т, 1,4-бензохиноном и др. h2 -Олефиновые комплексы Pd(0) с дибензилиденацетоном (DBA) типа [Pd(DBA)3] или [Pd2(DBA)3] используют для синтеза различных П. с.
[PdСl2(h2 -олефин)]2, а также прямым взаимод. PdCl2 с олефинами, напр. с изобутеном, стиролом, циклогексеном и др. Образующиеся h2 -олефиновые комплексы обычно неустойчивы и в зависимости от строения олефина и условий р-ции превращ. в h3 -аллильные комплексы с отщеплением НСl или дают продукты окисления олефинов (альдегиды или кетоны) при взаимод. с водой. h2 -Олефиновые комплексы Pd(0) получены с олефинами, имеющими электроноакцепторные заместители, напр. с производными малеиновой и фумаровой к-т, 1,4-бензохиноном и др. h2 -Олефиновые комплексы Pd(0) с дибензилиденацетоном (DBA) типа [Pd(DBA)3] или [Pd2(DBA)3] используют для синтеза различных П. с.
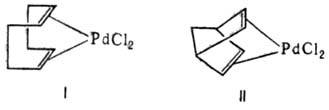
Из h2 -диеновых комплексов Pd устойчивы соед. с 1,4- и особенно 1,5-диенами, напр. с 1,5-циклооктадиеном (ф-ла I), дициклопентадиеном, норборнадиеном (ф-ла II):
1,3-Диены образуют с соед. Pd(II) h2 -олефиновые комплексы, к-рые затем перегруппировываются в h3 -аллильные. Комплексы с 1,5-диенами обратимо присоединяют нуклеофилы (Nu), гл. обр. RO Ч и СН 3 СОО Ч, b-дикетонат-анионы с образованием хелатных s, p-комплексов:
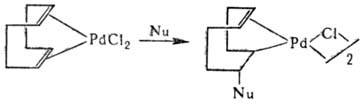
Фосфины, пиридин, диметилсульфоксид и др. мягкие основания вытесняют диеновые лиганды из комплексов Pd, напр.: [PdCl2(h4-C8H12 + (CH3)2SO
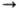 C8H12 + [PdCl2{(CH3)2 SO}2]. Получают h4 -диеновые комплексы Pd непосредственным взаимод. диенов с Na2PdCl4 или замещением на диен др. лигандов в комплексах Pd.
C8H12 + [PdCl2{(CH3)2 SO}2]. Получают h4 -диеновые комплексы Pd непосредственным взаимод. диенов с Na2PdCl4 или замещением на диен др. лигандов в комплексах Pd.
Циклобутадиеновые комплексы Pd получают взаимод. замещенных ацетиленов с комплексами Pd обычно с послед, обработкой HHal:
Циклобутадиеновый лиганд легко переносится с Pd на др. металлы (Mo, W, Fe, Co, Ni и др.).
Моноциклопентадиенильные комплексы Pd содержат в качестве др. лигандов фосфины, галогены, h3 -аллильную группу и т. д. h5 -С 5 Н 5 -лиганд легко отщепляется при действии разл. реагентов, напр.:
Получают их взаимод. соед. Pd с циклопентадиенидами металлов МС 5 Н 5 (М = Na, К, Li, Те):
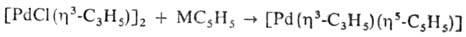
h2 -Ацетиленовые комплексы Pd(0) типа [Pd(RC
 CR) (PPh3)2] устойчивы, когда R-электроноакцепторные группы (CF3, COOCH3). Они образуются при р-циях [Pd(PPh3)4] с RC
CR) (PPh3)2] устойчивы, когда R-электроноакцепторные группы (CF3, COOCH3). Они образуются при р-циях [Pd(PPh3)4] с RC CR. Взаимод. [PdCl2(h2 -С 2 Н 4]2 или [Pd(NCPh)2Cl2] с RC
CR. Взаимод. [PdCl2(h2 -С 2 Н 4]2 или [Pd(NCPh)2Cl2] с RC CR (R = трет- С 4 Н 9 )приводит к ацетиленовому комплексу Pd(II) [PdCl2(h2-RC
CR (R = трет- С 4 Н 9 )приводит к ацетиленовому комплексу Pd(II) [PdCl2(h2-RC CR)]2. При р-циях с др. ацетиленами соед. Pd(II) дают h3 -аллильные комплексы или продукты ди-, три- и олигомеризации ацетиленов.
CR)]2. При р-циях с др. ацетиленами соед. Pd(II) дают h3 -аллильные комплексы или продукты ди-, три- и олигомеризации ацетиленов.
Известны также карбеновые комплексы Pd, к-рые образуются при присоединении спиртов и аминов к изонитриль-ным комплексам:
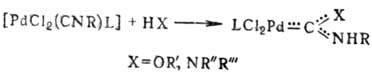
П, с,-важные промежут. продукты во мн. орг. р-циях, катализируемых соед. Pd. К ним относят окисление олефинов, олигомеризацию олефинов, диенов и ацетиленов, кар-бонилирование, винилирование, ацетоксилирование, изомеризацию и др. П. с. используют в орг. синтезе для образования связей СЧО, СЧHal, СЧN, СЧS, СЧSi. Нек-рые П. с.-эффективные катализаторы, напр, при карбонилирова-нии аллилгалогенидов (аллильные комплексы), при линейной димеризации и тримеризации бутадиена, ацетилирова-нии олефинов и аллена.
Лит.: Методы элементоорганической химии. Кобальт, никель, платиновые металлы, под ред. А. Н. Несмеянова, К. А. Кочешкова, М., 1978, с. 566-626; Comprehensive organometallic chemistry, ed. by G. Wilkinson, F. G. A. Stone, E.W. Abel, v. 6, N.Y., 1982, p. 243-469. Л. В. Рыбин.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
