- НИОБИЯ ГАЛОГЕНИДЫ
Известны пентагалогениды NbX5, тетрагалогениды NbX4 (большинство содержат группы Nb2), тригалогениды - фазы состава NbX2,67 (или Nb3X8)-NbX3+x (содержат группы Nb3 и Nb2), галогениды Nb6Xn, Nb6X14 и Nb6X15 с октаэдрич. группировками Nb6, оксигалогениды NbOX3, NbO2X и др., галогенсодер-жащие к-ты Nb, фторо-, оксофторо-, пероксофторо-, хлоро-, оксохлорониобаты, а также смешанные Н. г., напр. NbCl4F, тио- и селеногалогениды, напр. NbS2X2, NbSe2X2. Св-ва важнейших Н. г. приведены в таблице.
СВОЙСТВА ГАЛОГЕНИДОВ НИОБИЯ И НЕКОТОРЫХ ИХ ПРОИЗВОДНЫХ
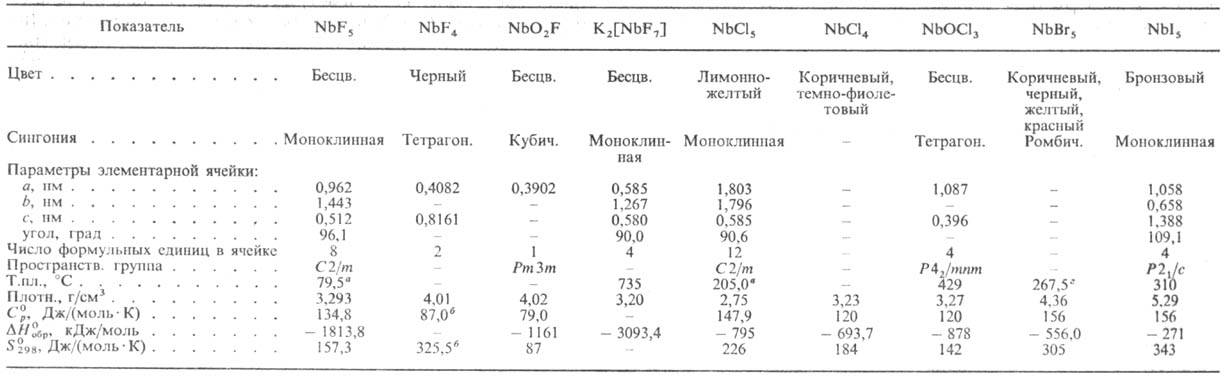
a Т. кип. 234,5°С. б Для газа. в Т. кип. 247,5°С. г Т. кип. 362,0°С.
П е н т а ф т о р и д н и о б и я NbF5 в парах ниже 400°С поли-меризован; DH0 пл 12,2 кДж/моль, DH0 исп 51 кДж/моль; ур-ние температурной зависимости давления пара lgр(IIa) = = 10,497-2778/Т (373 <= Т<= 423 К). Гидролизуется водой; восстанавливается Si, Nb и др. металлами до низших фторидов, выше 900 °С водородомЧдо металла. NbF5-K-Ta Льюиса. Образует фторониобаты M[Nb3F16], M[Nb2F11], M[NbF6] и др. Получают взаимод. Nb либо Nb2O5 с F2 при 300-450 °С или Nb с газообразным HF при 250-400 °С. NbF5 -промежут. продукт при получении Nb и Nb2O5; перспективен как реагент для получения покрытий из Nb и катализаторов гидрирования нефтепродуктов. Т е т р а ф т о-р и д н и о б и я NbF4 при 350-500°С диспропорционирует до Nb6F15 и NbF5; гидролизуется водой. Фторид Nb6F15 -темно-коричневые кристаллы с кубич. решеткой; выше 700°С диспропорционирует до Nb и NbF5. Д и о к с и ф т о р и д NbO2F выше 550 °С диспропорционирует до Nb3O7F (далее до Nb2O5) и газообразного о к с о т р и ф т о р и д а NbOF3; получают выпариванием досуха р-ра Nb во фтористоводородной к-те, взаимод. Nb2O5 с F2, HF, NbF5. При растворении Nb2O5 во фтористоводородной к-те образуются ф т о р о к и с л о т ы н и о б и я Nb2F11 .4Н 2 О, HNbF6.6H2O и HNbF6.H2O.
Г е п т а ф т о р о н и о б а т к а л и я K2[NbF7] плохо раств. во фтористоводородной к-те (~ 3,5% по массе в пересчете на NbF5 в 25%-ной HF); получают действием КСl на р-р Nb во фтористоводородной к-те; применяют для электролитич. или металлотермич. получения Nb. Г е к с а ф т о р о о к с о н и о-б а т а м м о н и я (NH4)3[NbOF6]-6ecцв. кристаллы с кубич. решеткой; плотн. 2,28 г/см 3; при 255, 320 и 420°С ступенчато разлагается до NbOF3, NbO2F и паров NbF5; получают взаимод. Nb2O5 с NH4HF2, как примесь при осаждении гидроксида Nb действием води. NH3 на фторид-ные р-ры Nb.
Для п е н т а х л о р и д а н и о б и я NbCl5 т-ра полиморфного перехода 183 °С, DH перехода 6,4 кДж/моль, DH0 пл 34 кДж/молъ, DH0 исп 52 кДж/моль; ур-ния температурной зависимости давления пара: lgр(Па) = 24,3834-5353/Т- 3,2204 lgT-7649/T2 (350 <=T<= 383 К), lgp(Па) = 10,49-2870/Т (483 <= Т<= 572 К); гидролизуется водой; раств. в ССl4, бензоле, толуоле и др. орг. р-рителях; образует аддук-ты с орг. основаниями, с хлоридами металлов-х л о р о -н и о б а т ы M[NbCl6]. Получают взаимод. Nb с Сl2 или ССl4 при 300-500 °С, Nb2O5 с ССl4, смесей Nb2O5 (или концентратов Nb с С) с Сl2. NbСl5 -промежут. продукт при получении чистого Nb2O5, покрытий и монокристаллов из Nb хим. осаждением из газовой фазы (NbCl5 + 2,5 Н 2
 Nb + 5HCl) или поликристаллич. Nb электролизом в среде NaCl-KCl. Тетрахлорид ниобия NbCl4 выше 300 °С диспропорционирует до NbCl3 и NbCl5, возгоняется в парах NbCl5; раств. в воде, давая синие р-ры; образует аддукты с орг. основаниями; получают взаимод. NbCl5 с Н 2, Nb или др. металлами при 450-500°С. Три-хлорид состава NbCl2,67-NbCl3,13 выделяют при взаимод. NbCl5 с Н 2 при 500-550 °С; не раств. в воде и разб. к-тах, окисляется конц. HNO3. Низшие хлориды - зеленый Nb3Cl8 и черный Nb6Cl14 получают при термич. разложении NbCl4. О к с о т р и х л о р и д NbOCl3 получают взаимод. NbCl5 с О 2 при 150-300 °С, NbCl5 с Nb2O5 при 200-350 °С, как побочный продукт при получении NbCl5.
Nb + 5HCl) или поликристаллич. Nb электролизом в среде NaCl-KCl. Тетрахлорид ниобия NbCl4 выше 300 °С диспропорционирует до NbCl3 и NbCl5, возгоняется в парах NbCl5; раств. в воде, давая синие р-ры; образует аддукты с орг. основаниями; получают взаимод. NbCl5 с Н 2, Nb или др. металлами при 450-500°С. Три-хлорид состава NbCl2,67-NbCl3,13 выделяют при взаимод. NbCl5 с Н 2 при 500-550 °С; не раств. в воде и разб. к-тах, окисляется конц. HNO3. Низшие хлориды - зеленый Nb3Cl8 и черный Nb6Cl14 получают при термич. разложении NbCl4. О к с о т р и х л о р и д NbOCl3 получают взаимод. NbCl5 с О 2 при 150-300 °С, NbCl5 с Nb2O5 при 200-350 °С, как побочный продукт при получении NbCl5.
П е н т а б р о м и д NbBr5 получают из Nb и Вr2 при 500°С, т е т р а б р о м и д NbBr4 (коричневое твердое в-во)-р-цией NbBr5 с Nb при 200-400 °С П е н т а и о д и д NbI5 (разлагается при нагр., гидролизуется водой) синтезируют из Nb и I2 при 250-600 °С, т е т р а и о д и д NbI4, т р и и о д и д NbI3 и низшие иодиды-при термич. разложении NbI5.
Э. Г. Раков, В. A. Myсорн.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
