- НАТРИИОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- ,
содержат связь NaЧС. Соед. AlkNa-бесцв. неплавкие в-ва, не раств. в углеводородах; ArNa и жирно-ароматич. Н. с.-твердые интенсивно окрашенные в-ва, не раств. в углеводородах, раств. в простых эфирах (иногда с разрывом связи СЧО); анион-радикальные Н. с. типа Na+[ArH]_Х плохо раств. в диэтиловом эфире; CH=CNa-слабо окрашенное твердое в-во; C5H5Na-6ecцв. кристаллы, не раств. в большинстве орг. р-рителей, раств. в ТГФ и жидком NH3.
Структура Н. с. установлена лишь для нек-рых соед., напр. CH3Na, по-видимому, тетрамср аналогично CH3Li; комплекс C5H5NaХL [L = (СН 3)2 NCH2CH2N (CH3)2] представляет собой цепочку из С 5 Н 5 -колец, связанных мостиковыми фрагментами NaХL. В р-рах Н. с. связи СЧNa обладают значительно большим ионным характером, чем связи СЧLi в литийорганических соединениях. В зависимости от типа Н. с. и природы среды в р-ре могут присутствовать отдельные ионы R- и Na+ , сольватно-разделенные и контактные ионные пары, либо существует равновесие между этими формами.
Н. с. очень чувствительны к О 2 воздуха и следам влаги (работают с ними в инертной атмосфере); на воздухе самовоспламеняются, C5H5Na обугливается, ArNa при осторожном окислении флуоресцируют. При нагр. без доступа воздуха AlkNa разлагаются с образованием NaH и олефинов; ArNa, HC=CNa и C5H5Na устойчивы к нагреванию. Н. с. карбеноидного типа RR'C(Na)Hal или o-NaC6H4Hal при термич. разложений образуют карбены RR'C: или дегидро-бензол.
Вода, к-ты, спирты разлагают Н. с. (иногда с возгоранием или взрывом). Н. с. взаимод. с СО 2, давая соли карбоновых к-т, и алкилирующими агентами; эти р-ции прогекают с сохранением конфигурации у sp3 -гибридизованного атома С, тогда как р-ции с галогенами протекают с обращением конфигурации. С карбонильными соед. Н. с. реагируют подобно литийорг. и магнийорг. соед. (см. Гриньяра реакция), однако в отличие от них AlkNa и ArNa разрывают связь СЧО в простых эфирах, напр. С 2 Н 5 ОС 2 Н 5 + + C2H5Na
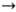 C2H5ONa + С 2 Н 4 + С 2 Н 6. Н. с. присоединяются по кратным связям, вступают в р-цию переметаллиро-вания, металлируют углеводороды с подвижным атомом водорода, взаимод. с галогенидами металлов с образованием металлоорг. соединений. Анион-радикальные Н. с. типа Na+ [АrН]_Х присоединяют атом Н с образованием продуктов восстановления, напр. при гидролизе C10Hg8_Х Na+ образуется 1,4-дигидронафталин. Для Н. с. характерны карб-анионные сигматропные согласованные перегруппировки, напр.
C2H5ONa + С 2 Н 4 + С 2 Н 6. Н. с. присоединяются по кратным связям, вступают в р-цию переметаллиро-вания, металлируют углеводороды с подвижным атомом водорода, взаимод. с галогенидами металлов с образованием металлоорг. соединений. Анион-радикальные Н. с. типа Na+ [АrН]_Х присоединяют атом Н с образованием продуктов восстановления, напр. при гидролизе C10Hg8_Х Na+ образуется 1,4-дигидронафталин. Для Н. с. характерны карб-анионные сигматропные согласованные перегруппировки, напр. 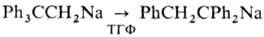 . Н. с. образуют комп лексы с др. металлоорг. соед., напр. Na+ [Ph2Li]-, к-рые устойчивы к простым эфирам (в отличие от PhNa).
. Н. с. образуют комп лексы с др. металлоорг. соед., напр. Na+ [Ph2Li]-, к-рые устойчивы к простым эфирам (в отличие от PhNa).
Н. с. обычно используют в виде суспензий или р-ров в орг. р-рителях, при упаривании к-рых м. б. получены индивидуальные твердые соединения. Осн. способы получения Н. с.: 1) взаимод. RCl с тонкодисперсным Na или амальгамой Na в орг. р-рителях; способ имеет ограниченное применение из-за побочной р-ции Вюрца (по этой же причине не используют RBr и RI), а также из-за возможного загрязнения продуктов NaCl и RCl.
2) Металлирование углеводородов с подвижным атомом водорода действием Na, NaNH2 или другого Н. с. (напр., CsH11Na или PhNa) по Шорыгина реакции:RH + R'Na
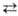 RNa + R'H. Равновесие р-ции смещено в сторону образования Н. с. более кислого углеводорода. Иногда р-цию проводят в присут. трет -С 4 Н 9 ОК или хелатирующих агентов.
RNa + R'H. Равновесие р-ции смещено в сторону образования Н. с. более кислого углеводорода. Иногда р-цию проводят в присут. трет -С 4 Н 9 ОК или хелатирующих агентов.
3) Р-ция переметаллирования: RnM + nNa
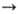 nRNa + М или RnM + R'Na
nRNa + М или RnM + R'Na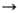 nRNa + R'n.M, где М - менее электроположительный, чем Na, элемент, чаще всего Hg или Sn. Метод используют для синтеза функциональнозамещенных и особо чистых Н. с.
nRNa + R'n.M, где М - менее электроположительный, чем Na, элемент, чаще всего Hg или Sn. Метод используют для синтеза функциональнозамещенных и особо чистых Н. с.
4) Расщепление эфиров или тиоэфиров металлич. Na, напр.:
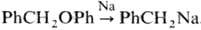
5) Присоединение Н. с. к кратным связям, напр.: Ph2C=CH2 + C5H11Na
 Ph2CNaCH2C5H11.
Ph2CNaCH2C5H11.
6) Взаимод. полиядерных ароматич. углеводородов с металлич. Na, обычно в эфире; при этом образуются пара-магн. соед. типа Na+ [ArH]_Х и (или) диамагнитные [ArH]2-2Na + .
Применяют Н. с. в орг. синтезе (менее широко, чем литий-и магнийорг. соед.), напр. в синтезе b, g-ненасыщ. карбонильных соед., полиацетиленов, др. элементоорг. соед., таких, как фенилсиланы; для превращения сульфонов в сульфиды; в качестве катализаторов анионной полимеризации непредельных соед.; для термостабилизации полимеров; C5H5Na и RC=CNa-в синтезе циклопентадиенильных и ацетиленовых производных др. элементов.
Лит.: Талалаева Т. В., Кочешков К. А., в кн.: Методы элементооргани-ческой химии. Литий, натрий, калий, рубидий, цезий, под ред. А. Н. Несмеянова и К. А. Кочешкова. кн. 2, М., 1971; Comprehensive organometallic chemistry, ed. by G. Wilkinson, v. 1, Oxf.-[a.o.], 1982, p. 43-120.
А.C. Перегудов.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
