- -ЛАКТАМНЫЕ АНТИБИОТИКИ
(Л. а.), содержат в молекуле b-лактамный цикл. Практически все природные Л. а. экстрагируют из культуральных жидкостей продуцентов. Механизм антибактериального действия заключается в блокировании конечной стадии синтеза стенки бактерий, в результате чего происходит лизис клетки. Различают бициклические и моноциклические Л. а. К первым относятся соед., в к-рых 4-члeнный лактамный цикл сконденсирован по атому N и соседнему с ним атому С с 5-членным гетероциклом - тиазолидиновым (пенамы), пирролиновым (карбапенамы) и оксазолидиновым (оксапенамы) - или с 6-членным дигидротиазиновым циклом (цефалоспорины и цефамицины). Пенамы включают пенициллины - первые Л. а., широко внедренные в мед. практику. Они продуцируются гл. обр. плесневыми грибами рода Penicillium. Пенициллины сравнительно легко претерпевают хим. деструкцию, обычно сопровождающуюся размыканием b-лактамного кольца. наиб. изучены бензилпенициллин, или пенициллин G (ф-ла I), и феноксиметилпенициллин, или пенициллин V (II). Бензилпенициллин почти утратил свое значение как лек. ср-во из-за широкого распространения резистентных микробов - возбудителей инфекции. Подавляющая часть выпускаемого пром-стью бензилпенициллина используется для получения 6-аминопенициллановой к-ты (6-АПК; ф-ла III) ферментативным гидролизом в присут. пенициллин-ацилазы, продуцируемой Escherichia coli.
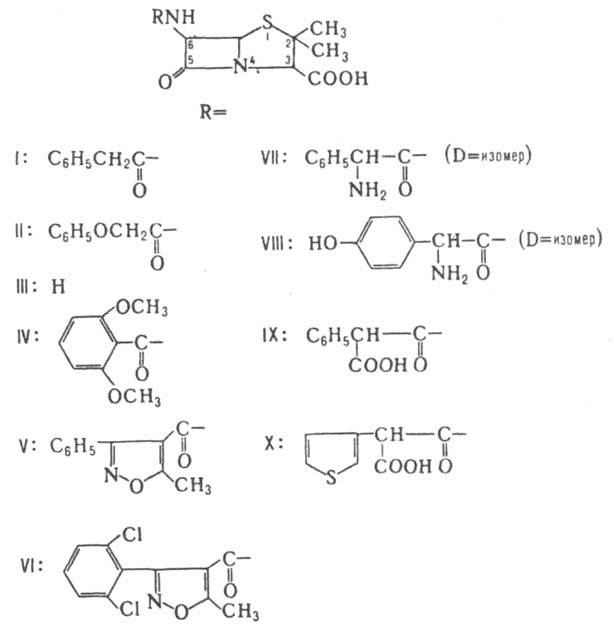
Прир. пенициллины подавляют гл. обр. грамположит. бактерии. Эти в-ва чувствительны к инактивирующему действию b-лактамаз (пенициллиназ) и др. ферментов бактериального происхождения, при действии к-рых размыкается b-лактамный цикл. Ацилированием 6-АПК, ее солей или эфиров хлорангидридами или ангидридами к-т получают разнообразные полусинтетич. пенициллины. Синтезировано св. 20 тыс. производных, из к-рых мед. применение нашли только неск. десятков. Биол. св-ва полусинтетич. пенициллинов зависят гл. обр. от характера заместителя в положении 6. Так, устойчивость к р-лактамазам обеспечивают объемные заместители, создающие стерич. препятствия разрыву р-лак-тамного цикла. Пенициллины с NH2- или СООН - группой в боковой цепи обладают, как правило, широким спектром действия. наиб. широко применяют метициллин (IV), оксациллин (V), диклоксациллин (VI), ампициллин (VII), амоксициллин (VIII), карбенициллин (IX) и тикарциллин (X). Большую группу полусинтетич. пенициллинов составляют производные соед. VII - азлоциллин (XI), мезлоциллин (XII) и пиперациллин (XIII), относящиеся к группе уреидопенициллинов, а также бакампициллин (XIV), гетациллин (XV) и др. Эти в-ва отличаются повыш. хим. стабильностью; кроме того, уреидопенициллины обладают более широким спектром действия, чем ампициллин. Производные IX с этерифицированной a-СООН - группой ацильного заместителя обладают тем же спектром антибактериального действия, что и исходное соед., но более устойчивы к b-лактамазам. Резко повышает устойчивость введение метоксильной группы в положение 6, как, напр., в темоциллине, или 6a-метокситикарциллине (XVI). При окислении атома S тиазолидинового цикла до сульфона образуются соед., способные подавлять b-лактамазы.
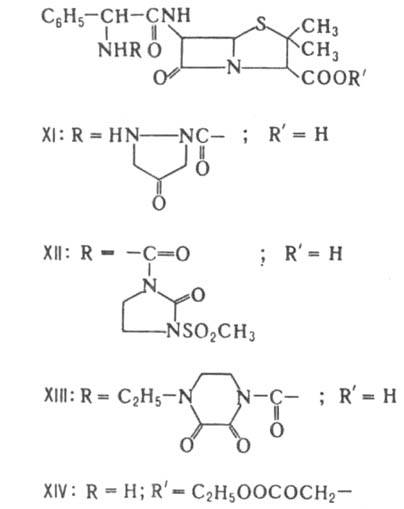
К пенамам относятся также амидинопенициллины, напр. мециллинам (XVII), к-рый отличается от пенициллинов более сложным механизмом гидролитич. расщепления. Соед. XVI и XVII подавляют преим. грамотрицат. бактерии.
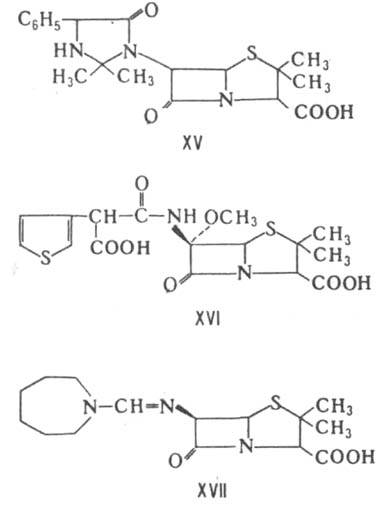
Карбапенамы - соед. обшей ф-лы XVIII. Продуцируются разл. микроорганизмами рода Streptomyces. Включают ок. 20 представителей. Характеризуются широким спектром антимикробного действия и способностью ингибировать b - лактамазы. Большинство карбапенамов-производные гипотетич. оливановой к-ты [в ф-лe XVIII R=b-СН 3 СН(ОН), R' =HOCH2CH2, n=0]. наиб. активностью обладают тиенамицин [R=a-CH3CH(OH), R'=NH2CH2CH2, n=0], карпетимицин A[R=b-(CH3)2C(OH), R'=CH2=CHNHCOCH2, n=1], соединение PS-5 [R=a-CH3CH(OH), R'=CH3QO)CH2CH2, n=0]. Из оксапенамов наиб. изучены клавулановая к-та (XIX), продуцируемая Streptomyces clavuligerus. Она обладает слабой антимикробной активностью, способна подавлять многие b-лактамазы. Применяется в сочетании с VIII (лек. препарат аугментин). Моноциклич. Л. а. включают прир. нокардицины и моно-бактамы, а также синтетич. азетидиноны, в первую очередь моносульфактамы. Хим. стабильностью и антимикробной
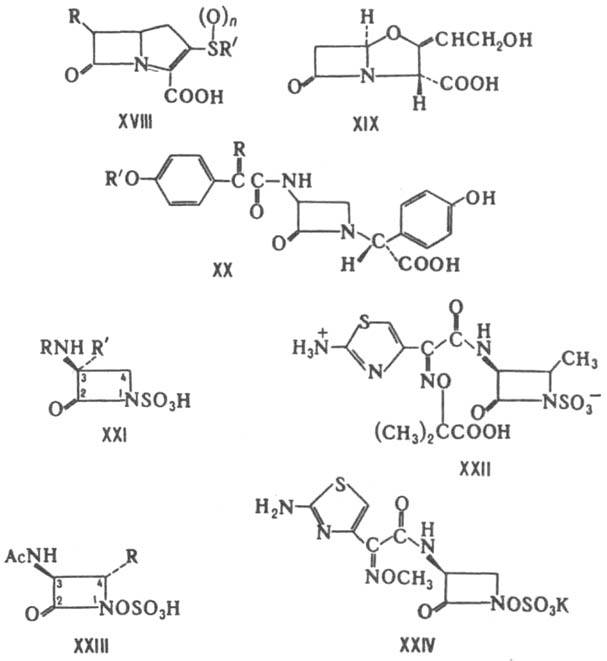
активностью характеризуются 2-азетидиноны с объемными электронодонорными заместителями при атоме N в b-лактамном цикле. Спектр антимикробного действия зависит гл. обр. от заместителя в положении 3. Нокардицины (общая ф-ла XX) продуцируются No-cardia uniformis subsp. tsuyamanensis. Подавляют грамотрицат. бактерии. Включают 6 представителей, наиб. активный из к-рых нокардицин А [в ф-ле XX R=(Z)-NOH, R'=D-HOOCCH(NH2)CH2CH2]. Монобактамы (общая ф-ла XXI; R'=Н или ОСН 3) продуцируются бактериями родов Acetobacterium, Gluconobacterium, Chromobacterium, отдельными видами Pseudomonas. Эти антибиотики обладают сравнительно низкой активностью против грамотрицат. бактерий, стабильны к b-лактамазам. Из синтетич. монобактамов наиб. интерес представляет получаемый из L-треонина азтреонам (XXII), к-рый отличается от природных высокой антибактериальной активностью. Моносульфактамы - синтетич. 2-азетидиноны (общая ф-ла XXIII; R=Н или СН 3). Их получают взаимод. производных L-серина или L-треонина с аминогидрокси-D-аланином и послед. циклизацией, О-сульфированием и N-ацилированием. наиб. широким антибактериальным спектром характеризуется моносульфактам (XXIV). Лит.: Итоги науки и техники, сер. Биологическая химия, т. 19, под ред. С. М. Навашина, М., 1983; Розенфельд Г. С., "Антибиотики и медицинская биотехнология", 1986, т. 31, №4, с. 302; Chemistry and biology of b-lactam antibiotics, ed. by R. B. Morin, M. German, v. 1-2, N.Y., 1982; Cimarusti C.M., Sykes R. В., "Med. Res. Rev.", 1984, v. 4, p. 1-24. Г. С. Розенфельд.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
