- ГРАФИТА СОЕДИНЕНИЯ
- соед. включения, образующиеся при внедрении атомов, ионов или молекул между углеродными слоями кристаллич. решетки графита. При этом используют в-ва, способные легко отдавать электроны (напр., щелочные металлы) или принимать их (напр., галогены, галогениды металлов). Образование Г. с. сопровождается разбуханием графита (вследствие раздвигания углеродных слоев) и существенным изменением его электрич. св-в.
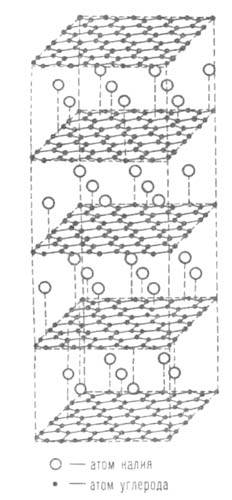
Кристаллич. решетка С 8 К; темные кружки -атомы углерода, светлые-калия>.
Соед. со щелочными металлами могут иметь составы С 8 М, С 16 М, С 24 М, С 36 М, С 40 М, С 64 М. Металл в решетке находится в виде атома; при его ионизации происходит перенос электронов в зону проводимости графита. Структура С 8 К представлена на рисунке. У этого соед. атомы металла располагаются над центрами гексаген, колец из атомов углерода. В соед. С 16 М атомы металла расположены так же, но только между каждой парой слоев графита. Аналогично построены и др. соединения. В случае С 64 М один ме-таллич. слой приходится на восемь углеродных.
В отличие от др. щелочных металлов, Na образует соед. с большим избытком углерода: из прир. графита получены C120Na, C64Na, C36Na, из искусственно полученного-
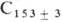 Na. По уменьшению деформирующего действия на решетку графита при образовании слоистых соед. щелочные металлы располагаются в ряд: Cs, Rb, К, Na, Li. Соед. с графитом образуют также др. металлы-Ва, Sr, Zn, Cd и многие РЗЭ. В соед. с галогенами происходит перенос электронов из зоны проводимости графита к атомам галогена, в результате чего образуются положительно заряженные дырки. наиб. известны бромсодержащие Г. с., напр. С 8 Вr. Синтезированы соед. с фтором состава CF0,676-CF0,998, C2F и C4F.
Na. По уменьшению деформирующего действия на решетку графита при образовании слоистых соед. щелочные металлы располагаются в ряд: Cs, Rb, К, Na, Li. Соед. с графитом образуют также др. металлы-Ва, Sr, Zn, Cd и многие РЗЭ. В соед. с галогенами происходит перенос электронов из зоны проводимости графита к атомам галогена, в результате чего образуются положительно заряженные дырки. наиб. известны бромсодержащие Г. с., напр. С 8 Вr. Синтезированы соед. с фтором состава CF0,676-CF0,998, C2F и C4F. Получены Г. с. с кислородсодержащими к-тами, напр. C24HSO4- *H2SO4 (гидросульфат графита). H2SO4 внедряется в решетку графита в виде ионов HSO4 или молекул. Известны соед. с HF, напр. C+24HF-2 *2H2F2.
Весьма многочисленны соед. с галогенидами (напр., с А1С13, FeCl3, ZrCl4, UC14, МоС15, MoF6, BrF3, IC1), оксига-логенидами (СrО 2 С12, CrO2F2, UO2C12, XeOF2), оксидами и сульфидами металлов. Их часто наз. "молекулярными комплексами", т. к. они образуются при внедрении галогенидов в решетку графита в виде молекул. Из соед. с галогенидами металлов наиб. изучено соед. с FeCl3, в к-ром содержание хлорида может достигать 56%; при этом возможные для заполнения слои заняты только на 92%. В случае А1С13 соед. имеет ф-лу С +m[АlС14 + nАlС13], где соотношение m:(n+l) составляет 1:9, 1:18 или 1:36. Сульфид или хлорид металла с переменной валентностью при внедрении в графит приобретает более высокую степень окисления.
Свойства. Соед. с небольшим содержанием внедрившегося в-ва имеют черный цвет и по внеш. виду мало отличаются от исходного графита. По мере увеличения содержания их цвет меняется сначала на сине-голубой, затем на желто-оранжевый.
Наиб. интересное св-во Г. с.- высокая электрич. проводимость, приближающаяся к проводимости Си или Ag, a в ряде случаев даже превышающая ее в 2-5 раз. Макс. проводимость характерна для соед. с акцепторами электронов, напр. с IC1. Так, электрич. проводимость вдоль оси а: для С 82IС11,08 0,9*10-3 Ом -1*m-1; для C16,3IC11,1, 2,8*10-3 Ом -1 *м -1; для С 33,0IС11,1 1,3*10-3 Ом -1*м -1. Эти зна-
чения в 70 раз превышают электрич. проводимость исходного пиролитич. графита и близки к проводимости Аи. С понижением т-ры электрич. проводимость Г. с. увеличивается. Соед. с К, Rb и Cs обладают сверхпроводящими св-вами.
Соед. со щелочными металлами не разлагаются при комнатной т-ре в инертной атмосфере; легко окисляются; взаи-мод. с Н 2 и N2. При высоких т-рах металл может испаряться. Хим. способами полностью удалить металл из соед. не удается. При повыш. т-рах большинство Г. с. отличается высокой хим. активностью. При термич. или хим. разложении, к-рое может протекать весьма бурно, слоистая структура сохраняется без изменений. При гидролизе из этих соед. выделяется только Н 2.
Особенность Г. с. с галогенами, нек-рыми галогенидами металлов и др.-способность удерживать часть внедрившихся атомов или молекул даже при высоких т-рах. Такие соед. наз. "остаточными", они устойчивы даже при нагревании в нейтральных средах и в вакууме до 1200-1500
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
