- Равновесие химическое
-
состояние системы, в которой обратимо протекает одна или несколько реакций химических (См. Реакции химические), причём для каждой из них скорости прямой и обратной реакций равны, вследствие чего состав системы остаётся постоянным, пока сохраняются условия её существования. В простейшем случае, когда система гомогенна и в ней протекает обратимая химическая реакцияА + В ⇔ С + D,скорость прямой реакции пропорциональна Концентрациям реагирующих веществυ1 = k1[A][B],а скорость обратной реакции пропорциональна концентрациям продуктов реакцииυ2 = k2[C][D],где k1 и k2 — соответствующие константы скоростей при данных условиях. В начальный момент, когда [С] и [D] равны нулю, υ2 = 0, a υ1 определяется начальными концентрациями А и В. По мере расходования этих веществ и образования веществ С и D υ1 уменьшается, a υ2 возрастает, затем они становятся равными (υ1 = υ2), т. е. устанавливается Р. х. Из равенства υ1 = υ2 следует, что
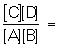 '
' где [С], [D], [А] и [В] — равновесные концентрации реагентов, а К — константа равновесия, зависящая для каждой обратимой реакции от внешних условий. Полученное соотношение есть выражение Действующих масс закона; оно характеризует тот предел, до которого может меняться исходный состав системы при самопроизвольном течении реакции в данных условиях, т. е. без затраты работы извне. В условиях Р. х. концентрации (активности (См. Активность)) всех реагентов связаны между собой и нельзя изменить ни одной из них без того, чтобы не изменились все остальные. Приведённое выражение для К справедливо в случае газовых реакций при невысоких давлениях и в разбавленных растворах.Термодинамически Р. х. — и в гомогенных, и в гетерогенных системах — характеризуется как состояние, наиболее устойчивое в данных условиях, т. е. такое, в котором (в зависимости от способа задания внешних условий) та или иная термодинамическая функция состояния (см. Термодинамика химическая) достигает своего минимального или максимального значения. Для изолированных систем, т. е. не обменивающихся веществом и энергией с внешней средой, такой функцией является Энтропия. При Р. х. энтропия системы максимальна. Если возможен теплообмен с окружающей средой, но температура и давление в системе постоянны, то минимальное значение принимает изобарно-изотермический потенциал (см. Гиббсова энергия). При постоянстве температуры и объёма минимума достигает изохорно-изотермический потенциал (см. Гельмгольцева энергия).Зависимость Р. х. от внешних условий в качественной форме выражается Ле Шателье - Брауна принципом, в количественной — соответствующими термодинамическими уравнениями. Так, влияние температуры выражается уравнениями изобары (См. Изобара) или изохоры (См. Изохора) реакции.Изучение Р. х. имеет большое теоретическое и практическое значение, особенно возросшее в связи с проведением процессов в сложных многокомпонентных системах. Большие трудности исследования химических реакций при высоких температурах (высокотемпературная химия) экспериментальными методами вызвали интенсивное развитие расчётов равновесных составов смесей при заданных начальных внешних условиях и исходных концентрациях (или количествах) компонентов. В химической технологии определение положения Р. х. при различных давлениях и температурах и учёт скоростей реакций позволяют выбирать оптимальные условия процесса, в частности условия максимального выхода химических продуктов. Большое значение приобрёл расчёт начального состава смеси по заданному, а также состава квазиравновесных систем, в которых одна или несколько термодинамически возможных реакций практически не осуществляются или в силу своих кинетических особенностей идут очень медленно.Лит.: Курс физической химии, под общ. ред. Я. И. Герасимова, 2 изд., т. 1, М., 1969; Термодинамические и теплофизические свойства продуктов сгорания. Справочник, т. 1, М., 1971.М. Е. Ерлыкина.
где [С], [D], [А] и [В] — равновесные концентрации реагентов, а К — константа равновесия, зависящая для каждой обратимой реакции от внешних условий. Полученное соотношение есть выражение Действующих масс закона; оно характеризует тот предел, до которого может меняться исходный состав системы при самопроизвольном течении реакции в данных условиях, т. е. без затраты работы извне. В условиях Р. х. концентрации (активности (См. Активность)) всех реагентов связаны между собой и нельзя изменить ни одной из них без того, чтобы не изменились все остальные. Приведённое выражение для К справедливо в случае газовых реакций при невысоких давлениях и в разбавленных растворах.Термодинамически Р. х. — и в гомогенных, и в гетерогенных системах — характеризуется как состояние, наиболее устойчивое в данных условиях, т. е. такое, в котором (в зависимости от способа задания внешних условий) та или иная термодинамическая функция состояния (см. Термодинамика химическая) достигает своего минимального или максимального значения. Для изолированных систем, т. е. не обменивающихся веществом и энергией с внешней средой, такой функцией является Энтропия. При Р. х. энтропия системы максимальна. Если возможен теплообмен с окружающей средой, но температура и давление в системе постоянны, то минимальное значение принимает изобарно-изотермический потенциал (см. Гиббсова энергия). При постоянстве температуры и объёма минимума достигает изохорно-изотермический потенциал (см. Гельмгольцева энергия).Зависимость Р. х. от внешних условий в качественной форме выражается Ле Шателье - Брауна принципом, в количественной — соответствующими термодинамическими уравнениями. Так, влияние температуры выражается уравнениями изобары (См. Изобара) или изохоры (См. Изохора) реакции.Изучение Р. х. имеет большое теоретическое и практическое значение, особенно возросшее в связи с проведением процессов в сложных многокомпонентных системах. Большие трудности исследования химических реакций при высоких температурах (высокотемпературная химия) экспериментальными методами вызвали интенсивное развитие расчётов равновесных составов смесей при заданных начальных внешних условиях и исходных концентрациях (или количествах) компонентов. В химической технологии определение положения Р. х. при различных давлениях и температурах и учёт скоростей реакций позволяют выбирать оптимальные условия процесса, в частности условия максимального выхода химических продуктов. Большое значение приобрёл расчёт начального состава смеси по заданному, а также состава квазиравновесных систем, в которых одна или несколько термодинамически возможных реакций практически не осуществляются или в силу своих кинетических особенностей идут очень медленно.Лит.: Курс физической химии, под общ. ред. Я. И. Герасимова, 2 изд., т. 1, М., 1969; Термодинамические и теплофизические свойства продуктов сгорания. Справочник, т. 1, М., 1971.М. Е. Ерлыкина.
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
