- Гидраты
-
суть определенные химические соединения, содержащие в своем составе элементы воды. Между ними различают гидраты в собственном смысле, соединения с кристаллизационной водой и некоторые растворы, обладающие свойствами определенных химических соединений. К первым принадлежат такие соединения, в которых, на основании некоторых реакций их образования и их превращений, вода принимается содержащеюся в виде водных остатков ОН (гидроксил). Таковы кислоты, гидраты оснований, или водные окиси, и спирты, или алкоголи. Общей для всех их формулой будет R(ОН)n, где R есть элемент или сложная группа атомов, например, водная окись натрия, или едкий натр Na(HO), водная окись кальция, или едкая известь Са(НО)2, кислоты азотная NO2(OH), серная SO2(OH)2, борная R(OH)3, уксусная C2H3O(OH), обыкновенный винный спирт C2H5(HO), глицерин С3Н3(ОН)3 и т. п. Они могут рассматриваться, как вода, в которой произошло замещение одного атома водорода каким-нибудь R, например, натрием, что видно из сопоставления формул воды и едкого натра
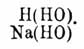 Сколько частиц воды принимало участие в замещении, столько и водных остатков находится в гидрате, например:
Сколько частиц воды принимало участие в замещении, столько и водных остатков находится в гидрате, например: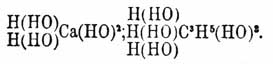 Число же частиц воды определяется эквивалентностью R. Такое замещение может быть воспроизведено и в действительности. Так, натрий и др. щелочные, а также щелочноземельные металлы выделяют из воды газообразный водород и дают соответствующие Г. Из других реакций их образования на первом плане следует поставить действие воды на хлорангидриды или другие галоидангидриды, так как эта реакция с ясностью показывает справедливость принятого воззрения на Г., как гидроксильные соединения, ибо здесь один атом водорода воды соединяется с атомом хлора хлорангидрида, образуя хлористый водород HCl, а остаток воды ОН вступает на место хлора хлорангидрида, образуя гидрат. Так образуется, например, серная кислота при разложении водой хлористого сульфурила:SO2Cl2 + 2Н2O = SO2(OH)2 + 2HClили уксусная кислота из хлористого ацетила:C2H3OCl + Н2O = С2H3О(НО) + HCl.Основные Г. не образуются этой реакцией, вследствие прочности по отношению к воде отвечающих им хлористых соединений. Однако, присутствие и в них водных остатков можно видеть из обратной реакции, именно получения хлористых металлов при действии хлористого водорода на основные Г., при чем водород хлористого водорода соединяется с водным остатком гидрата, образуя воду, а хлор становится на его место в гидрате, например:Са(НО)2 + 2HCl = CaCl2 + 2Н(НО).Многие Г. образуются прямым соединением безводных тел (ангидридов) с водой, напр.:SO3 + Н2O = Н2SO4;СаО + Н2O = Са(НО)2.Далее, они могут получиться при реакциях двойного разложения солей с другими Г. (реакция, важная для получения Г. слабых кислотных и основных окислов, не способных прямо соединяться с водой), напр.:CuSO4 + 2Na(HO) = Cu(НО)3 + Na2SO4;(NaO)2SiO3 + Н2SO4 = (HO)2SiO + Na2SO4.В подобные же реакции могут вступать и сложные эфиры; таково, например, омыление их щелочами по уравнению:C2H3O2(C2H5) + NaHO = C2H3O(NaO) + C2H3(HO).Наконец, Г. можно получить путем образования в соединениях водных остатков при реакциях окисления и восстановления; так уксусный альдегид (вещество ангидридное, водных остатков не содержащее), присоединяя кислород, дает уксусную кислоту, а, соединяясь с водородом, образует спирт:C2H3O. H + О = C2H3O(HO);C2H4O + H2 = C2H5(OH).Одним нагреванием часто нельзя или трудно выделить из Г. воду, в них содержащуюся (известь, серная кислота), а иногда и вовсе нельзя даже при сильнейшем накаливании (едкий натр, метафосфорная кислота). В некоторых случаях легче достигается полное разложение гидрата, чем разложение его на воду и ангидрид (спирт, уксусная, азотная кислота). Но есть между Г. и легко теряющие воду и даже такие, которые едва способны к самостоятельному существованию. Теряя воду, многие гидраты, прежде образования ангидридов, могут переходить в ангидрогидраты, т. е. гидраты с меньшим количеством воды; так наиболее богатый водой гидрат фосфорной кислоты, ортофосфорная кислота РО(НО)3, при нагревании до 300° образует пирофосфорную кислоту (РО)2(НО)2O, а эта последняя при прокаливании дает метафосфорную РО2(НО); подобным же образом для кремнезема (см.) и мн. др. существуют многочисленные ряды гидратов с постепенно убывающим содержанием воды. Будучи лишь в незначительной мере способны к реакциям прямого соединения, гидраты с легкостью, и это для них весьма характерно, вступают в реакции двойного разложения, причем их водные остатки или водород последних обмениваются на атомы галоидов, металлов и сложные атомные группы (остатки спиртов и кислот), образуя галоидангидриды, соли и сложные эфиры и выделяя воду или газообразный водород. Замещение водных остатков кислот и спиртов хлором и образование из них хлорангидридов происходит при действии PCl5:C2H3O(OH) + PCl3 = C2H3OCl + POCl3 + HCl;водные основания обменивают ОН на Cl, как уже было указано выше, при действии соляной кислоты HCl, образуя хлористые металлы. Через замещение водных остатков оснований и спиртов остатками кислот при реакциях двойного разложения получаются соли и сложные эфиры:Na(HO) + H(NO3) = Na(NO3) + Н2O;C2H5(HO) + H(C2H3O2) = C2H5(C2H3O2) + H2O.Кислоты и спирты обменивают водород своих водных остатков на металлы при взаимодействии с металлами или их окисями и гидратами, причем образуются соли или алкоголяты, напр.:H2SO2 + Zn = ZnSO4 + Н2;HaSO4 + ZnO = ZnSO4 + Н2O;H2SO2 + Zn(HO2) = ZnSO4 + 2H2O;C2H5(HO) + Na = C2H5(NaO) (алкоголят натрия) + H2.П. П. Рубцов Δ.
Число же частиц воды определяется эквивалентностью R. Такое замещение может быть воспроизведено и в действительности. Так, натрий и др. щелочные, а также щелочноземельные металлы выделяют из воды газообразный водород и дают соответствующие Г. Из других реакций их образования на первом плане следует поставить действие воды на хлорангидриды или другие галоидангидриды, так как эта реакция с ясностью показывает справедливость принятого воззрения на Г., как гидроксильные соединения, ибо здесь один атом водорода воды соединяется с атомом хлора хлорангидрида, образуя хлористый водород HCl, а остаток воды ОН вступает на место хлора хлорангидрида, образуя гидрат. Так образуется, например, серная кислота при разложении водой хлористого сульфурила:SO2Cl2 + 2Н2O = SO2(OH)2 + 2HClили уксусная кислота из хлористого ацетила:C2H3OCl + Н2O = С2H3О(НО) + HCl.Основные Г. не образуются этой реакцией, вследствие прочности по отношению к воде отвечающих им хлористых соединений. Однако, присутствие и в них водных остатков можно видеть из обратной реакции, именно получения хлористых металлов при действии хлористого водорода на основные Г., при чем водород хлористого водорода соединяется с водным остатком гидрата, образуя воду, а хлор становится на его место в гидрате, например:Са(НО)2 + 2HCl = CaCl2 + 2Н(НО).Многие Г. образуются прямым соединением безводных тел (ангидридов) с водой, напр.:SO3 + Н2O = Н2SO4;СаО + Н2O = Са(НО)2.Далее, они могут получиться при реакциях двойного разложения солей с другими Г. (реакция, важная для получения Г. слабых кислотных и основных окислов, не способных прямо соединяться с водой), напр.:CuSO4 + 2Na(HO) = Cu(НО)3 + Na2SO4;(NaO)2SiO3 + Н2SO4 = (HO)2SiO + Na2SO4.В подобные же реакции могут вступать и сложные эфиры; таково, например, омыление их щелочами по уравнению:C2H3O2(C2H5) + NaHO = C2H3O(NaO) + C2H3(HO).Наконец, Г. можно получить путем образования в соединениях водных остатков при реакциях окисления и восстановления; так уксусный альдегид (вещество ангидридное, водных остатков не содержащее), присоединяя кислород, дает уксусную кислоту, а, соединяясь с водородом, образует спирт:C2H3O. H + О = C2H3O(HO);C2H4O + H2 = C2H5(OH).Одним нагреванием часто нельзя или трудно выделить из Г. воду, в них содержащуюся (известь, серная кислота), а иногда и вовсе нельзя даже при сильнейшем накаливании (едкий натр, метафосфорная кислота). В некоторых случаях легче достигается полное разложение гидрата, чем разложение его на воду и ангидрид (спирт, уксусная, азотная кислота). Но есть между Г. и легко теряющие воду и даже такие, которые едва способны к самостоятельному существованию. Теряя воду, многие гидраты, прежде образования ангидридов, могут переходить в ангидрогидраты, т. е. гидраты с меньшим количеством воды; так наиболее богатый водой гидрат фосфорной кислоты, ортофосфорная кислота РО(НО)3, при нагревании до 300° образует пирофосфорную кислоту (РО)2(НО)2O, а эта последняя при прокаливании дает метафосфорную РО2(НО); подобным же образом для кремнезема (см.) и мн. др. существуют многочисленные ряды гидратов с постепенно убывающим содержанием воды. Будучи лишь в незначительной мере способны к реакциям прямого соединения, гидраты с легкостью, и это для них весьма характерно, вступают в реакции двойного разложения, причем их водные остатки или водород последних обмениваются на атомы галоидов, металлов и сложные атомные группы (остатки спиртов и кислот), образуя галоидангидриды, соли и сложные эфиры и выделяя воду или газообразный водород. Замещение водных остатков кислот и спиртов хлором и образование из них хлорангидридов происходит при действии PCl5:C2H3O(OH) + PCl3 = C2H3OCl + POCl3 + HCl;водные основания обменивают ОН на Cl, как уже было указано выше, при действии соляной кислоты HCl, образуя хлористые металлы. Через замещение водных остатков оснований и спиртов остатками кислот при реакциях двойного разложения получаются соли и сложные эфиры:Na(HO) + H(NO3) = Na(NO3) + Н2O;C2H5(HO) + H(C2H3O2) = C2H5(C2H3O2) + H2O.Кислоты и спирты обменивают водород своих водных остатков на металлы при взаимодействии с металлами или их окисями и гидратами, причем образуются соли или алкоголяты, напр.:H2SO2 + Zn = ZnSO4 + Н2;HaSO4 + ZnO = ZnSO4 + Н2O;H2SO2 + Zn(HO2) = ZnSO4 + 2H2O;C2H5(HO) + Na = C2H5(NaO) (алкоголят натрия) + H2.П. П. Рубцов Δ.
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — С.-Пб.: Брокгауз-Ефрон. 1890—1907.
