- Газовые взрывы
-
могут получиться только с такими газами, которые представляют или механические смеси, содержащие в себе, с одной стороны, элементы горючие (углерод, водород и т. п.), с другой — поддерживающие горение (кислород, хлор); или однородные химические соединения, способные распадаться на элементы со значительным отделением тепла (см. Взрывчатые вещества). Для изучения Г. взрывов служили главным образом смеси водорода H2, окиси углерода СО и болотного газа СН4 с кислородом или с воздухом, дающие при воспламенении воду Н2O и углекислоту СО2 с огромным отделением тепла Q (на граммовую частицу, в больших или килограммовых калориях).------------------------------------------------------------------------------------------| H2 + О = Н2О (жид.) | Q = 69,0 кал. ||----------------------------------------------------------------------------------------|| СО + О = СО2 | 68,2 кал. ||----------------------------------------------------------------------------------------|| СН4 + 2О2 = СО2 + 2Н2О (жид.) | 213,5 кал. |------------------------------------------------------------------------------------------В предлагаемой статье рассматриваются: I) пределы воспламеняемости, II) температуры воспламенения, III) скорость взрывов, IV) давления при взрывах и V) взрывы смесей светильного газа с воздухом, применяемые в газовых двигателях.I) Пределы воспламеняемости. Г. взрывы вызываются местным возвышением температуры, напр., с помощью накаленного тела, зажигательного стекла, электрической искры и т. п. Но для этого количественный состав смесей не должен выходить из известных пределов. В самом деле, если разведем вышеуказанные взрывчатые смеси большим избытком одного из взятых газов или другим инертным газом, то температуры, развивающиеся в слоях, ближайших к точке воспламенения, вследствие значительной затраты тепла для нагревания не участвующего в горении газа могут опуститься ниже температуры воспламенения смеси, и распространение Г. взрыва на всю массу станет невозможным. Следовательно, для каждой смеси существуют определенные пределы воспламеняемости. Так, по опытам Гей-Люссака, Деви, Бунзена и др., водородный гремучий газ (Н2 + О) перестает взрывать, когда к 3 объемам его примешаны 27 объемов кислорода или 24 объема водорода, или: 18 объемам азота, 12 об. окиси углерода, 9 об. углекислого газа, 6 объемов сернистого газа, 3 объема болотного газа и т. п.; смесь окиси углерода с кислородом (СО + О) перестает взрывать при разбавлении 3 объемов ее 10 объемами окиси углерода или 29 объемами кислорода; смесь 2 об. болотного газа с 11 объемами воздуха — при увеличении пропорции последнего до 17 — 20 объемов и пр. Расчет показывает, однако, что одной охлаждающей способности газов, присутствующих в избытке, недостаточно для объяснения замечаемого в приведенных примерах различия пределов; необходимо допустить еще специальное влияние натуры примешанных газов.По мере приближения к пределам воспламеняемости, горение основной (нормальной) смеси делается неполным, что явствует, напр., из наблюдений Гей-Люссака над сжатием после взрыва водородного гремучего газа, разбавляемого кислородом: пока на 3 объема гремучего газа приходится не более 17 объемов кислорода, сжатие равно 3 объемам, т. е. такое же, как в отсутствии избытка кислорода; но при 18 объемах избытка кислорода сжатие уже 1,4 объема, и затем стремится к нулю. Пределы воспламеняемости могут отчасти отодвигаться в ту или другую сторону, в зависимости от способа воспламенения, и особенно от температуры и массы прикасающегося накаленного тела. Сверх того, Деви показал, что смеси, воспламеняющиеся при обыкновенной их плотности, перестают воспламеняться, если сильно уменьшить их плотность; так, электрическая искра не воспламеняет водородного гремучего газа, взятого при плотности, в 18 раз меньшей сравнительно с обыкновенной, т. е. разрежение оказывает такое же влияние, как и разбавление не участвующими в горении газами. Смеси воздуха с болотным газом, выделяющимся в рудниках, могут воспламениться, по опытам Деви, при изменении содержания болотного газа от 6% до 24%; ниже 6% слишком в большом избытке находится воздух, а выше 24% — болотный газ.II. Температуры воспламенения. Распространение горения при Г. взрывах основано на существовании определенных температур, необходимых для воспламенения газовой смеси. Деви показал, что железная проволока около 0,65 мм толщиною воспламеняет водородный гремучий газ уже при темно-красном калении; для воспламенения же смеси окиси углерода с кислородом она должна быть нагрета до красного каления, а рудничный гремучий газ не всегда воспламеняется даже при белом ее калении. Для измерения температур воспламенения Ле Шателье и Малляр употребляли фарфоровый, нагреваемый в газовой печи Перро, пирометр, который служил то как воздушный термометр, то как камера для взрыва, для чего он был снабжен стеклянным краном с двумя каналами, позволявшими приводить его в сообщение попеременно с воздушным насосом и градуированными трубками, содержавшими воздух или гремучую смесь. Установив по возможности постоянную температуру в печи, измеряли ее, наполнив прибор воздухом; затем тотчас же, удалив воздух выкачиванием, вводили исследуемую гремучую смесь; воспламенение узнавалось по звуку взрыва или по изменению объема газа; после взрыва тотчас же снова заменяли газ воздухом и опять измеряли температуру печи; средняя величина ее отмечалась. Если взрыв не происходил, то в следующем опыте давали несколько высшую температуру; если же происходил — бралась несколько низшая температура. и т. д., пока не получались достаточно узкие пределы температур.----------------------------------------------------------------------------------------------| Смеси | Пределы темп. || | воспламенения ||---------------------------------------------------------------------------------------------|| 2 об. Н + 1 об. О | 560 — 570° ||---------------------------------------------------------------------------------------------|| 2 " Н + 4 " О | 530 — 532° ||---------------------------------------------------------------------------------------------|| 2 " Н + 4 " воздуха | 552 — 553° ||---------------------------------------------------------------------------------------------|| 2 " Н + 1 " О + 3 об. СО2 | 562 — 592° ||---------------------------------------------------------------------------------------------|| 5 " СО + 1 " О | 630 — 650° ||---------------------------------------------------------------------------------------------|| 2 " СО + 1 " О | 645 — 650° ||---------------------------------------------------------------------------------------------|| 2 " СО + 4 " воздуха | 650 — 657° ||---------------------------------------------------------------------------------------------|| 2 " СО + 1 " О + 3 об. СО2 | 695 — 715° ||---------------------------------------------------------------------------------------------|| 2 " СН4 + 4 " О | 630 — 650° ||---------------------------------------------------------------------------------------------|| 2 " СН4 + 1 " О | 650 — 660° ||---------------------------------------------------------------------------------------------|| 2 " СН4 + 18 " воздуха | 650 — 750° |----------------------------------------------------------------------------------------------Из этих чисел следует: а) температура воспламенения гремучих газов мало изменяется даже от большой примеси посторонних газов; более значительно лишь влияние углекислоты на смеси, содержащие окись углерода. б) Гремучие смеси, содержащие окись углерода, взрывают при значительно высшей температуре, чем водородные. Кроме того, Малляр и Ле Шателье заметили, что смеси, содержащие СО и СН4, при более низких температурах, показывают явления медленного горения; напр., смесь 2 об. СО + 1 об. О горит уже около 480° со скоростью 0,01% в секунду. Смеси, содержащие болотный газ, проявляют еще способность взрываться, при известных температурах, лишь по истечении известного промежутка времени — тем большего, чем ниже температура, в то время как смеси с водородом или окисью углерода взрывают непосредственно; так, замедление около 800° составляет 5 — 6 секунд и делается неощутимым лишь около 1000°. Температура воспламенения определяется не только составом газовой смеси, но также присутствием (прикосновением, контактом) некоторых особых тел, действующих своею поверхностью подобно нагреванию. Такие тела вообще понижают температуру Г. взрыва. Особенно ясно влияют тела пористые, порошковатые, обладающие большой поверхностью. Можно принимать, что это зависит от того, что на поверхности таких тел происходит довольно сильное сжатие тонкого слоя газа, благоприятствующее соединению смешанных газов и их нагреванию. Наибольшим контактным действием обладают палладий, платина и уголь. Платиновая проволока воспламеняет водородный гремучий газ при слабом нагревании, губчатая платина — при обыкновенной температуре, а в мелко раздробленном состоянии, в каком она находится, напр., в пепле бумаги, напитанной перед сожжением так называемой нашатырной платиной (PtCl4.2NH4Cl), даже при холоде — 20°. Уголь производит воспламенение при 350°. Проф. Коновалов показал, что подобное влияние на химические превращения производится также стеклом и стенками всяких сосудов, употребляемых при опытах, хотя и в гораздо более слабой степени. Из сказанного о понижении температур воспламенения действием контакта следует, что числовые данные Малляра и Ле Шателье имеют значение только в фарфоровых сосудах. Это заключение подтверждают и расширяют исследования (1892) В. Мейера, произведенные с водородным гремучим газом в стеклянных оболочках. Смесь 2 об. Н + 1 об. О, полученная (электролизом) в возможно чистом состоянии, в запаянных трубках, также очищенных самым тщательным образом, взрывается тотчас при введении этих трубок в сосуд с сильно кипящим хлористым оловом (606°). Но если гремучий газ свободно пропускается через трубку, нагреваемую при той же температуре, то взрыва не бывает, а происходит весьма незначительное медленное окисление, которое в запаянных сосудах может иметь место и при более низких температурах, напр., в парах сернистого фосфора (518°) и серы (448°); в этих условиях, т. е. когда реакция происходит без условий увеличенного давления, для воспламенения необходима высшая температура кипящего хлористого цинка (730°); кипящий же бромистый цинк (650°) не производит взрыва. Откуда точка воспламенения свободно проходящего гремучего газа в стекле лежит между 650° и 730°. Воспламенение газовых гремучих смесей в некоторых случаях обуславливается присутствием водяных паров. По опытам Диксона ("Chem. News", 46, 151), смесь окиси углерода и кислорода, тщательно высушенная фосфорным ангидридом, не взрывает ни искрой от Румкорфовой спирали, ни раскаленной платиновой проволокой; но если прибавить следы влажности, то взрыв происходит тотчас же. Траубе объясняет такую роль малых количеств водяного пара тем, что окисление окиси углерода совершается насчет кислорода воды, водород которой соединяется с присутствующим свободным кислородом в перекись водорода Н2О2; последняя, в свою очередь, может окислять:СО + Н2О + О2 = СО2 + Н2O2;СО + Н2O2 = CO2 + Н2O и т. д.Действительно, если жечь окись углерода близ поверхности воды, то в последней можно доказать присутствие перекиси водорода. То же самое имеет место и при взрыве водородного гремучего газа: первоначально образуется Н2О2, которая затем распадается на Н2О и О, что гораздо ранее того утверждал проф. Д. И. Менделеев на основании того, что следы перекиси водорода давно найдены (Струве и др.) при многих случаях горения и частичные количества (см. Частицы) водорода и кислорода отвечают как раз Н2O2.III. Скорость распространения взрыва. Смотря по условиям воспламенения, одна и та же взрывчатая смесь газов может то постепенно сгорать с большею или меньшею скоростью, то давать место так называемой взрывной волне (см. Взрывчатые вещества). 1) При постепенном горении реакция распространяется от слоя к слою только вследствие передачи тепла непосредственно через теплопроводность. Каждая смесь характеризуется некоторой определенной скоростью такой передачи последовательного горения. Для измерения этих скоростей применялись, главным образом, два метода: или, сообщив газовой смеси такое поступательное движение, чтобы пламя оставалось неподвижным, замечали скорость течения газовой смеси; или, воспламенив смесь в длинной трубке, замечали передвижение пламени. Первый метод был применен Бунзеном: взрывчатая смесь, заключенная в сосуд, выпускалась через узкое отверстие в тонкой стенке наружу и здесь зажигалась; затем, ослабляя скорость вытекания газа, достигали того, что пламя перескакивало внутрь сосуда; в этот момент скорость движения смеси принималась равною скорости распространения горения, и, следовательно, для определения последней нужно было только измерить скорость вытекания. Поступая таким образом, Бунзен нашел, что при атмосферном давлении и температуре в смеси 2 об. Н + 1 об. О горение распространяется со скоростью 34 м в секунду, а в смеси 2 об. СО + 1 об. О эта скорость равна 1 метру. Но скорости вытекания в различных частях узкого отверстия в тонкой стенке весьма неодинаковы (снаружи от трения течение медленнее, как в реке у берегов), и перескакивание пламени внутрь сосуда происходит тотчас же, как только наименьшая из этих скоростей начинает едва уступать распространению горения в данной смеси; следовательно, искомая скорость распространения горения по этому методу получится больше наблюдаемой. Так как каждое спокойное пламя газовой (Бунзеновской) горелки находится в некотором подвижном равновесии, то для измерения нормальных скоростей Михельсон (из Москвы) предложил воспользоваться близким изучением этого пламени. В самом деле, на каждом элементе поверхности ds (фиг. 1) с самой высокою температурою, ограничивающей снаружи внутренний конус пламени, нормальная к ней, составляющая скорости истечения газа v, равна и противоположна нормальной скорости распространения горения u.
 Фиг. 1. Внутренней конус Бунзеновского пламени; v — скорость вытекания смеси из горелки; u — нормальная скорость горения.Легко уяснить себе, что, обозначая поверхность внутреннего конуса через S и объем протекшей через горелку взрывчатой газовой смеси через V, окончательно должно иметь место отношение: V = uS; откуда u = V/S. Объем V определяется непосредственно, измерение же S точнее удается, делая в определенном масштабе фотографические снимки пламени. Этим способом действительно получаются скорости меньшие, сравнительно с найденными Бунзеном: для смеси 2 об. Н + 1 об. О — около 9 м в секунду, для 2 об. СО + 1 об. О — около 0,9 м и т. п.Второй из вышеозначенных методов применялся Малляром и Ле Шателье. Воспламеняя смеси в трубках, открытых с одного конца, и следя глазами за пламенем, замечали моменты прохождения его через различные точки по секундомеру; или передвижение пламени записывалось на вращающемся (рядом с трубкою) цилиндре, причем скорость вращения его отмечалась колеблющимся камертоном, а подача сигналов основана была на произведении взрывов в небольших боковых камерах, сообщающихся с трубкою; взрыв в каждой камере, происходивший тотчас по достижении пламени, производил давление на закрывающую ее диафрагму, снабженную пером, и через нее делал отметку на цилиндре. При воспламенении с открытого конца были получены следующие результаты:----------------------------------------------------------------------------| Водородные смеси: | Скорость || Состав. | распространения в || | секунду: ||---------------------------------------------------------------------------|| 2 об. H + 1,5 об. О | 17 м ||---------------------------------------------------------------------------|| 2,5 об. Н + 1 об. О | 18 " ||---------------------------------------------------------------------------|| 2 об. Н + 2 об. О | 10 " ||---------------------------------------------------------------------------|| 3 об. Н + 1 об. О | 12 " |----------------------------------------------------------------------------Смесь 2 об. Н + 1 об. О давала несогласные числа в различных опытах, но Малляр и Ле Шателье находят возможным принять для нее скорость около 20 м. Очевидно, что избыток одного из образующих смесь газов производит уменьшение скорости. Употребляя вместо чистого кислорода воздух, с изменением пропорции смешения замечается, что максимум скорости отвечает 2 объемам водорода на 3 об. воздуха (4,4 метра в секунду), а не теоретической смеси для образования воды в отношении 2 объемов Н на 5 об. воздуха (около 3,4 метра). То же самое наблюдается и для смесей других горючих газов с кислородом, или воздухом: смесь, 2 объема СО + 1 объем О, сгорает со скоростью 2,2 метра в секунду; но максимум скорости падает на смеси, содержащие на 1 объем О около 3 объемов СО; смесь болотного газа, составленная в пропорции для полного горения, 2 объема СН4 + 20 объем. воздуха, дает скорость 0,40 метра, между тем как при пропорции 2,3 об. CH4 на 20 объем. воздуха величина скорости равна 0,58 метра. Причина влияния избытка того или другого газа на скорость распространения горения лежит в охлаждающем действии этого избытка, так как известно, что скорости взрывчатых превращений падают с температурою (см. Взрывчатые вещества). По Малляру и Ле Шателье, скорость распространения постепенного горения, вероятно, пропорциональна коэффициенту теплопроводности смеси, а также избытку температуры горения над температурою воспламенения и обратно пропорциональна избытку последней над начальною температурою. Действительно, примешивание к взрывчатой смеси углекислого газа, обладающего большой теплоемкостью, производит более значительное понижение скорости, чем примешивание такого же объема азота, имеющего меньшую теплоемкость (при равных объемах); с возрастанием начальной температуры смеси возрастает и скорость; избыток водорода, обладающего хорошей теплопроводностью, дает понижение скорости в меньшей степени, чем равный объем кислорода и т. п. По отношению к этому методу следует заметить, что вскоре после воспламенения не начавшая еще гореть газовая смесь приходит в движение, которое, по наблюдению самих же авторов, может быть не только поступательным, но и колебательным; а такое движение, содействуя перемешиванию, должно увеличивать скорость. Следующий опыт показывает, как именно может происходить распространение горения в гремучих газах, заключенных в трубках, при воспламенении с открытого конца. Взяв смесь паров сернистого углерода CS2 и окиси азота NO в стеклянной трубке в 3 метра длиною и в 3 сантиметра шириною (при горении образуются с ярким светом СО2, SO3 и N2), посредством фотографического объектива отбрасывают изображение трубки с пробегающим в ней пламенем на чувствительную бумагу, навернутую на вращающийся цилиндр. При этом на бумаге получаются кривые, по которым возможно вообще отличить несколько периодов: 1) пламя сперва распространяется спокойно (без звука) и приблизительно равномерно; 2) затем оно колеблется, подаваясь то вперед, то назад; 3) наконец, перемещается на протяжении остальной части трубки с такою огромной скоростью, что за этот промежуток времени цилиндр не успевает повернуться на заметную величину (на фотографиях получается прямая линия, параллельная оси вращения) и слышится звук взрыва. По объяснению Маляра и Ле Шателье, эти три периода являются, как следствие самих условий горения в трубках. Воспламенение первого слоя (у открытого конца) производит увеличение объема этого слоя, что вызывает сжимание соседнего слоя, за которым непосредственно следует расширение его; это сжатие и расширение передаются далее со скоростью распространения звука, пока не достигнут закрытого конца, где образовавшаяся волна отражается назад. Сжатия, производимые вначале давлением горящих слоев, недостаточны для воспламенения, и потому в первый период горение будет продолжаться лишь посредством теплопроводности. Когда первая отраженная волна встретится с пламенем, то она, вызывая некоторое перемешивание газов, произведет ускорение распространения горения; вместе с этим начинается второй период, и колебательные движения пламени усиливаются с каждою следующею, отраженною от закрытого конца, волною. Суммирование отраженных волн увеличивает сжатие слоев более и более, пока одного его не окажется достаточным для воспламенения; в этот момент начнется третий период и произойдет то, что Бертело назвал взрывною волною. Условия для наступления второго и третьего периода особенно благоприятны при воспламенении с закрытого конца трубки; оттого в этом случае всегда наблюдаются значительно большие скорости. Но, очевидно, что при воспламенении с открытого конца, несмотря на предосторожности брать только начальные наблюдения, как это делали Малляр и Ле Шателье, выводимые скорости распространения горения все-таки могут оказаться больше действительных, вследствие неизвестности, где именно начинается второй период.Приведенные отношения взрывчатых газовых смесей объясняют некоторые явления при взрывах в копях. Если в галерее, оканчивающейся глухим концом, рудничный гремучий газ загорится при входе в нее, то пламя распространяется по ней спокойно, обжигая и задушая рудокопов. Если же воспламенение случится в глубине такой галереи, то огонь распространяется с сильным взрывом, производя на своем пути большие механические разрушения. Лампы Деви, безопасные в спокойном рудничном газе, бывали причиною взрывов в галереях с сильною тягою, так как металлические сетки их не останавливают горения, делающегося более быстрым, вследствие облегчения перемешивания.2) исследования над скоростью горения при взрывных волнах были произведены первоначально Бертело и Вьейлем ("Sur la force des matières explosives", t. I, p. 133). Для опытов служили длинные (около 40 метров) свинцовые или каучуковые трубки в 5 мм в диаметре. В двух точках трубки Т — Т, находящихся на точно определенном расстоянии, нормально к направлению трубки помещали очень узкие оловянные полоски SS (см. рис. 2), изолированные бумагою и зажатые с помощью оправ cc; на каждой полоске в части l, приходящейся против центра канала, приклеивали около 0,01 г гремучей ртути, для прерывания тока в момент соприкосновения с пламенем.
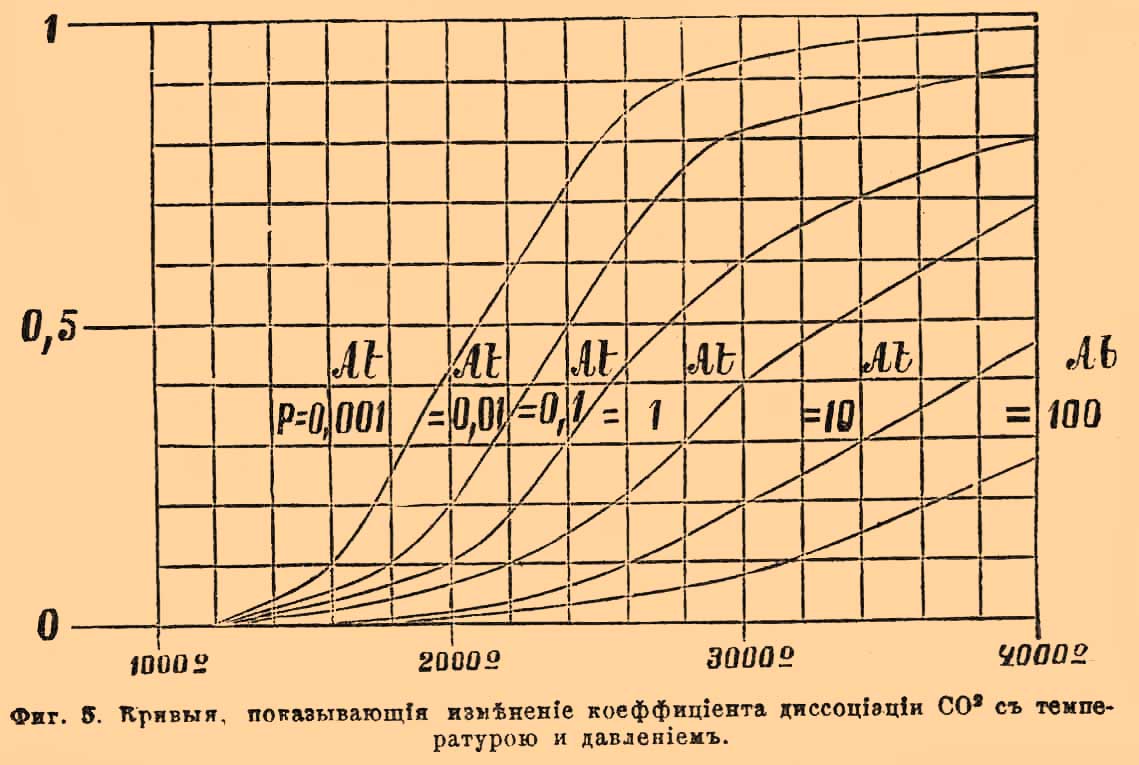
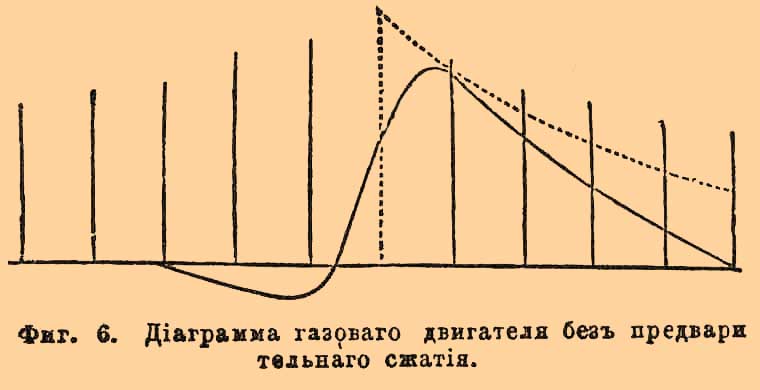
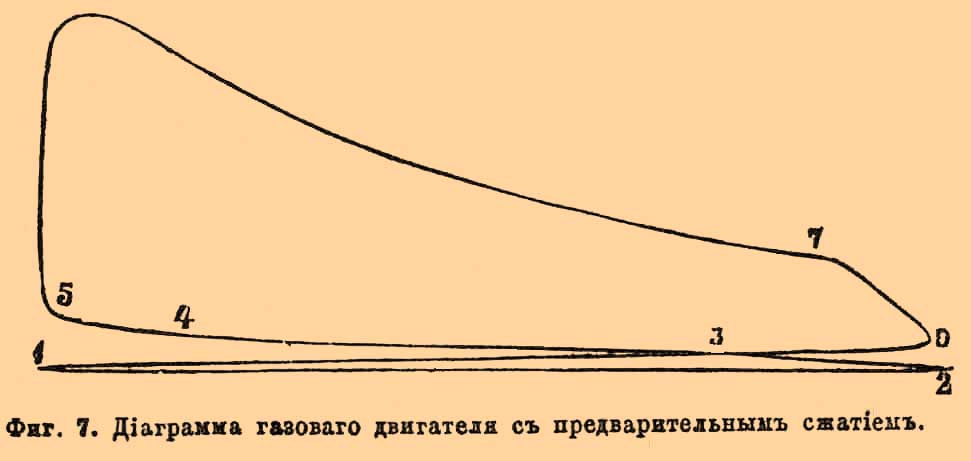
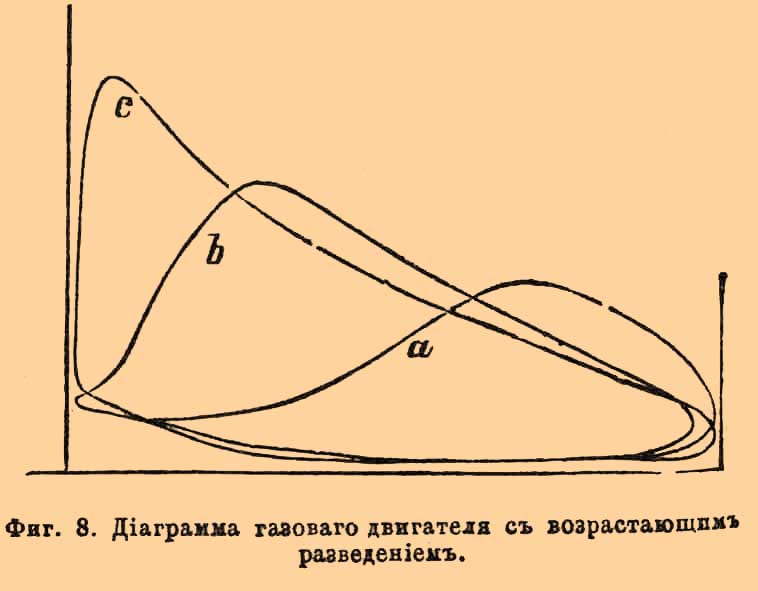
Фиг. 1. Внутренней конус Бунзеновского пламени; v — скорость вытекания смеси из горелки; u — нормальная скорость горения.Легко уяснить себе, что, обозначая поверхность внутреннего конуса через S и объем протекшей через горелку взрывчатой газовой смеси через V, окончательно должно иметь место отношение: V = uS; откуда u = V/S. Объем V определяется непосредственно, измерение же S точнее удается, делая в определенном масштабе фотографические снимки пламени. Этим способом действительно получаются скорости меньшие, сравнительно с найденными Бунзеном: для смеси 2 об. Н + 1 об. О — около 9 м в секунду, для 2 об. СО + 1 об. О — около 0,9 м и т. п.Второй из вышеозначенных методов применялся Малляром и Ле Шателье. Воспламеняя смеси в трубках, открытых с одного конца, и следя глазами за пламенем, замечали моменты прохождения его через различные точки по секундомеру; или передвижение пламени записывалось на вращающемся (рядом с трубкою) цилиндре, причем скорость вращения его отмечалась колеблющимся камертоном, а подача сигналов основана была на произведении взрывов в небольших боковых камерах, сообщающихся с трубкою; взрыв в каждой камере, происходивший тотчас по достижении пламени, производил давление на закрывающую ее диафрагму, снабженную пером, и через нее делал отметку на цилиндре. При воспламенении с открытого конца были получены следующие результаты:----------------------------------------------------------------------------| Водородные смеси: | Скорость || Состав. | распространения в || | секунду: ||---------------------------------------------------------------------------|| 2 об. H + 1,5 об. О | 17 м ||---------------------------------------------------------------------------|| 2,5 об. Н + 1 об. О | 18 " ||---------------------------------------------------------------------------|| 2 об. Н + 2 об. О | 10 " ||---------------------------------------------------------------------------|| 3 об. Н + 1 об. О | 12 " |----------------------------------------------------------------------------Смесь 2 об. Н + 1 об. О давала несогласные числа в различных опытах, но Малляр и Ле Шателье находят возможным принять для нее скорость около 20 м. Очевидно, что избыток одного из образующих смесь газов производит уменьшение скорости. Употребляя вместо чистого кислорода воздух, с изменением пропорции смешения замечается, что максимум скорости отвечает 2 объемам водорода на 3 об. воздуха (4,4 метра в секунду), а не теоретической смеси для образования воды в отношении 2 объемов Н на 5 об. воздуха (около 3,4 метра). То же самое наблюдается и для смесей других горючих газов с кислородом, или воздухом: смесь, 2 объема СО + 1 объем О, сгорает со скоростью 2,2 метра в секунду; но максимум скорости падает на смеси, содержащие на 1 объем О около 3 объемов СО; смесь болотного газа, составленная в пропорции для полного горения, 2 объема СН4 + 20 объем. воздуха, дает скорость 0,40 метра, между тем как при пропорции 2,3 об. CH4 на 20 объем. воздуха величина скорости равна 0,58 метра. Причина влияния избытка того или другого газа на скорость распространения горения лежит в охлаждающем действии этого избытка, так как известно, что скорости взрывчатых превращений падают с температурою (см. Взрывчатые вещества). По Малляру и Ле Шателье, скорость распространения постепенного горения, вероятно, пропорциональна коэффициенту теплопроводности смеси, а также избытку температуры горения над температурою воспламенения и обратно пропорциональна избытку последней над начальною температурою. Действительно, примешивание к взрывчатой смеси углекислого газа, обладающего большой теплоемкостью, производит более значительное понижение скорости, чем примешивание такого же объема азота, имеющего меньшую теплоемкость (при равных объемах); с возрастанием начальной температуры смеси возрастает и скорость; избыток водорода, обладающего хорошей теплопроводностью, дает понижение скорости в меньшей степени, чем равный объем кислорода и т. п. По отношению к этому методу следует заметить, что вскоре после воспламенения не начавшая еще гореть газовая смесь приходит в движение, которое, по наблюдению самих же авторов, может быть не только поступательным, но и колебательным; а такое движение, содействуя перемешиванию, должно увеличивать скорость. Следующий опыт показывает, как именно может происходить распространение горения в гремучих газах, заключенных в трубках, при воспламенении с открытого конца. Взяв смесь паров сернистого углерода CS2 и окиси азота NO в стеклянной трубке в 3 метра длиною и в 3 сантиметра шириною (при горении образуются с ярким светом СО2, SO3 и N2), посредством фотографического объектива отбрасывают изображение трубки с пробегающим в ней пламенем на чувствительную бумагу, навернутую на вращающийся цилиндр. При этом на бумаге получаются кривые, по которым возможно вообще отличить несколько периодов: 1) пламя сперва распространяется спокойно (без звука) и приблизительно равномерно; 2) затем оно колеблется, подаваясь то вперед, то назад; 3) наконец, перемещается на протяжении остальной части трубки с такою огромной скоростью, что за этот промежуток времени цилиндр не успевает повернуться на заметную величину (на фотографиях получается прямая линия, параллельная оси вращения) и слышится звук взрыва. По объяснению Маляра и Ле Шателье, эти три периода являются, как следствие самих условий горения в трубках. Воспламенение первого слоя (у открытого конца) производит увеличение объема этого слоя, что вызывает сжимание соседнего слоя, за которым непосредственно следует расширение его; это сжатие и расширение передаются далее со скоростью распространения звука, пока не достигнут закрытого конца, где образовавшаяся волна отражается назад. Сжатия, производимые вначале давлением горящих слоев, недостаточны для воспламенения, и потому в первый период горение будет продолжаться лишь посредством теплопроводности. Когда первая отраженная волна встретится с пламенем, то она, вызывая некоторое перемешивание газов, произведет ускорение распространения горения; вместе с этим начинается второй период, и колебательные движения пламени усиливаются с каждою следующею, отраженною от закрытого конца, волною. Суммирование отраженных волн увеличивает сжатие слоев более и более, пока одного его не окажется достаточным для воспламенения; в этот момент начнется третий период и произойдет то, что Бертело назвал взрывною волною. Условия для наступления второго и третьего периода особенно благоприятны при воспламенении с закрытого конца трубки; оттого в этом случае всегда наблюдаются значительно большие скорости. Но, очевидно, что при воспламенении с открытого конца, несмотря на предосторожности брать только начальные наблюдения, как это делали Малляр и Ле Шателье, выводимые скорости распространения горения все-таки могут оказаться больше действительных, вследствие неизвестности, где именно начинается второй период.Приведенные отношения взрывчатых газовых смесей объясняют некоторые явления при взрывах в копях. Если в галерее, оканчивающейся глухим концом, рудничный гремучий газ загорится при входе в нее, то пламя распространяется по ней спокойно, обжигая и задушая рудокопов. Если же воспламенение случится в глубине такой галереи, то огонь распространяется с сильным взрывом, производя на своем пути большие механические разрушения. Лампы Деви, безопасные в спокойном рудничном газе, бывали причиною взрывов в галереях с сильною тягою, так как металлические сетки их не останавливают горения, делающегося более быстрым, вследствие облегчения перемешивания.2) исследования над скоростью горения при взрывных волнах были произведены первоначально Бертело и Вьейлем ("Sur la force des matières explosives", t. I, p. 133). Для опытов служили длинные (около 40 метров) свинцовые или каучуковые трубки в 5 мм в диаметре. В двух точках трубки Т — Т, находящихся на точно определенном расстоянии, нормально к направлению трубки помещали очень узкие оловянные полоски SS (см. рис. 2), изолированные бумагою и зажатые с помощью оправ cc; на каждой полоске в части l, приходящейся против центра канала, приклеивали около 0,01 г гремучей ртути, для прерывания тока в момент соприкосновения с пламенем. Фиг. 2. Прерыватель для подачи сигналов при взрыве (разрез по оси трубок). ТТ — трубки; ss — оловянные полоски; сс — оправы для зажимания; l — место для прикрепления гремучей ртути.Промежуток времени между двумя перерывами измерялся с помощью хронографа Ле Буланже, соединенного проводниками с оловянными полосками. Воспламенение сообщалось посредством сильной электрической искры. Бертело и Вьейль, употребляя различные газовые смеси и меняя условия, описанным способом получили следующие результаты: а) скорость распространения взрывной волны несравненно превосходит скорость постепенного горения, не зависит от материала трубок и представляет для каждого гремучего газа совершенно определенную и характерную величину. Так, для смеси, 2 об. Н + 1 об. О, она равна 2810 м в секунду, для 2 об. СО + 1 об. О — 1100 м, для 2 об. СН4 + 4 об. О — 2290 метров и т. п.; б) скорости взрывных волн, подобно скорости звука, не зависят от начального давления: в) характерные для каждой смеси наибольшие скорости, при воспламенении электрической искрой, получаются не сразу, а лишь после того, как взрывы передвигаются на некоторое расстояние от места воспламенения; напр., для смеси 2 об. Н + об. О лишь после передвижения на 1/2 метра скорость достигает постоянной величины (в пределах погрешностей измерений). Это расстояние увеличивается с ослаблением силы воспламеняющей искры и с уменьшением диаметра трубок ниже 2 миллиметров; г) примешивание какого-либо постороннего газа к гремучей смеси уменьшает скорость взрывной волны, и если разведение достигает значительных пределов, то она совсем прекращается.------------------------------------------------------------------------------------| Смеси. | Скорости волн ||-----------------------------------------------------------------------------------|| 2 об. Н + 1 об. O + 2 об. N | 2121 м ||-----------------------------------------------------------------------------------|| 2 " Н + 4,7 " воздуха | 1439 " ||-----------------------------------------------------------------------------------|| 2 " Н + 6,6 " " | 1205 " ||-----------------------------------------------------------------------------------|| 2 " Н + 7,2 " " | волны нет |------------------------------------------------------------------------------------Пределы состава смесей, вне которых взрывные волны перестают распространяться, гораздо уже пределов воспламеняемости. Весьма вероятно, что эти пределы могут отчасти раздвинуться при употреблении для воспламенения значительных доз гремучей ртути. Постоянство скоростей распространения взрывных волн и зависимость их лишь от состава гремучих смесей Бертело объясняет на основании связи их с температурами, которые развиваются при горении. Хотя вычисление этих температур сомнительно вследствие диссоциации систем и неизвестности теплоемкостей газов при высоких температурах, но, находя их в предположении отсутствия диссоциации и неизменяемости атомной теплоемкости при постоянном давления (3, 4) и вычисляя средние скорости поступательного движения газообразных продуктов горения по формуле Клаузиуса 29,354√(τ/ρ) оказывается, что эти скорости близки к скоростям распространения взрывных волн:--------------------------------------------------------------------------------------------------------------| Смеси | Вычисл. скорость | Скор. взрывных || | частиц | волн. ||------------------------------------------------------------------------------------------------------------|| 2 об. Н + 1 об. О | 2831 м | 2810 м ||------------------------------------------------------------------------------------------------------------|| 2 " СО + 1 " О | 1941 " | 1100 " ||------------------------------------------------------------------------------------------------------------|| 2 " ОН4 + 4 " О | 2427 " | 2287 " |--------------------------------------------------------------------------------------------------------------Если же это действительно так, то понятно, что скорость взрывной волны не может быть больше скорости поступательного движения частиц при данной температуре и что причины, производящие охлаждение, должны уменьшать скорость волны в том же отношении, как и скорость частичных движений сгорающих слоев, что и замечается в действительности. Результаты, полученные Бертело и Вьейлем, были подтверждены Диксоном (в Манчестере); но этот исследователь, кроме того, показал, что скорость взрывной волны в 2 об. СО + 1 об. О заметно увеличивается с влажностью смеси: не совсем сухая смесь дает скорость 1264 м, а насыщенная при 35° водяным паром — 1738 м в секунду. Вероятно, что с увеличением количества водяного пара, играющего существенную роль в горении окиси углерода, увеличивается быстрота самой реакции окисления, которая и позволяет скорости распространения волны развиться до своей предельной величины, определяемой скоростью поступательного движения продуктов горения.IV. Давления при Г. взрывах были предметом довольно большого числа исследований. Выбирая только важнейшие, должно сказать, что первые сюда относящиеся измерения принадлежат Бунзену. Гремучая смесь вводится в стеклянный цилиндрический сосуд, помещенный над ртутью (рис. 3).Фиг. 3. Эвдиометр Бунзена для определения давлений. Грузы a и b, надавливая через стержень d, уравновешивают упругость газов.Закрыв его пришлифованною стеклянною пластинкою, к которой приклеена еще железная пластинка со стержнем, проходящим сквозь для пропускания искры, помещают на внешнюю пластинку другой стержень d, соединенный с рычагом, носящим подвижные грузы а и b, для производства соответствующего давления; воронка, прижатая на каучуковом кольце к тому же краю стеклянного сосуда, позволяет с помощью небольшого количества воды достигнуть совершенной укупорки введенного газа. Если груз, надавливающий на пластинку, очень велик, то взрыв происходит без всякого звука и вода в воронке остается спокойною; если же он очень мал, то слышится звук и вода выбрасывается. Очевидно, меняя грузы, можно довольно точно найти такой, который только едва уравновешивает давление газов при взрыве и который поэтому будет мерою последнего. Описанным способом Бунзен нашел, что 2 об. Н + 1 об. О развивают при взрыве 9,6 атм., 2 об. СО + 1 об. О дают 10,3 атм., и т. п. Способ Бунзена, по опытам Малляра и Ле Шателье, дает погрешности, доходящие до 10%. Более точных результатов эти исследователи достигли с прибором следующего устройства. Камерою для взрыва служил железный цилиндр в 4 литра (с диаметром, равным высоте). Верхнее основание его имело 4 отверстия — одно для проводников, другое для сообщения с воздушным насосом, третье для ртутного манометра, четвертое для введения изучаемых газов, а нижнее основание — только одно отверстие для сообщения с манометром, записывающим давления во время взрыва. С этою целью употреблялся манометр Бурдона, наполняемый водою (для смягчения толчка) и приходящий в движение при возрастании в нем давления; игла, передающая это движение, чертила соответственную кривую давлений на цилиндре, вращающемся со скоростью 1 метра в секунду. Кривые давлений имеют восходящую и нисходящую ветви; первая отвечает периоду распространения взрыва, вторая — охлаждению газов по окончании взрыва. По этим кривым можно было находить законы охлаждения газов и вводить поправки к наблюденным максимальным давлениям для перечисления последних на такие давления, которые получились бы, если бы в период распространения взрыва окружающие стенки не производили никакого охлаждения. Кроме того, изучение охлаждения около максимума давлений позволяло судить, имела ли место диссоциация при взрыве: в этом случае замечается замедление охлаждения, как, например, при взрыве 2 об. СО + 1 об. О, ибо по мере охлаждения все новое количество СО + О переходит в СО2 с отделением тепла. Малляр и Ле Шателье получили: для водородного гремучего газа, содержащего около 4% азота и водяного пара, 9,2 атм., для смеси 2 об. СО + 1 об. О, содержащей 6% азота и водяного пара — 8,6 атм., для смеси 2 об. СН4 + 4 об. 0 — 14 атм. и т. п. При постепенном разбавлении нормальных гремучих смесей другими какими-либо газами, давления уменьшаются также постепенно, а не со скачками, как раньше думал Бунзен на основании своих опытов (менее точных).Метод, подобный описанному, применен был также Клерком ("Chem. News", 63, p. 207) для измерения давлений (индикатором Рихарда) взрывчатых смесей с воздухом; напр.,------------------------------------------------------------------------------------------------------------------------------------------------------------| Состав смеси | Максимум | Продолжит. | ||-------------------------------| давления | взрыва | Падение давления. || Н | возд. | | | ||----------------------------------------------------------------------------------------------------------------------------------------------------------|| 1 об. | 6 об. | 3,8 ат. | 0,150 с. | Спустя 0,065 сек. после максимума ||----------------------------------------------------------------------------------------------------------------------------------------------------------|| 1 " | 4 " | 5,6 " | 0,026 " | Тотчас после достижения максимума ||----------------------------------------------------------------------------------------------------------------------------------------------------------|| 2 " | 5 " | 6,4 " | 0,010 " | Тотчас после достижения максимума |------------------------------------------------------------------------------------------------------------------------------------------------------------Более продолжительное удерживание максимума давления разбавленными смесями дает повод заключить, что диссоциация не есть единственная причина, ограничивающая возрастание и падение давлений при газовых взрывах. По мнению Клерка, горение подобно другим обратимым реакциям, т. е. сначала протекает очень быстро и по мере приближения к концу замедляется; а в таком случае максимум давления отвечает такому состоянию системы, когда скорость охлаждения равна скорости доставления тепла; другими словами — горение продолжается и после достижения максимума давления. Бертело и Вьейль применяли для измерения давлении при газовых взрывах способ, основанный на изучении закона движения поршня определенного сечения и массы. Опыты производились в бомбах (подобных описанным в соотв. статье), емкостью в 0,300, 1,500 и 4,000 л. Наиболее высокие давления получаются, когда в роли горючего газа взяты углеводороды, болотный газ СН4, маслородный газ С2Н4, ацетилен С2H2, метиловый эфир (СН3)2O и циан C2N2, а сожигающим газом служат окислы азота NO и N2O. Так, для смеси 2 об. СН4 + 4 об. О, взятой при нормальных условиях, давление равно 16,34 атм., смесь 2 об. C2N2 + 4 об. О дает 20,96 атм., 2 об. С2N2 + 8 об. N2O — 22,66 атм. и т. п.Изучение давлений при Г. взрывах дает возможность судить о теплоемкостях газов при высоких температурах. Если принять, что все газы при высокой температуре следуют законам Мариотта и Гей-Люссака, то из наблюденного при взрыве давления Р можно вывести температуру горения Т по воздушному термометру, ибоТ/t0 = Р/Рогде t0 есть 0°, или обыкновенная температура, а р0 — окончательное давление продуктов взрыва при этой температуре (считая и воду газообразной). Но приведенное уравнение имеет место лишь при условии, что при взрыве не происходит диссоциации образующихся газов, поэтому предварительно следует уяснить, когда и в какой мере это действительно можно принять.С.-Клер-Девиль доказал качественно диссоциацию водяного пара и углекислого газа выше 1000°; в то же время, применяя свой метод быстрого охлаждения (см. Диссоциация), показал для СО2, что коэффициент ее диссоциации под обыкновенным давлением около 1300° равен почти 0,002, а при температуре горения смеси окиси углерода с кислородом (по Малляру и Ле Шателье около 3000°) равен приблизительно 0,40. Крафтс, на основании определения расширения СО2 при высоких температурах, заключил, что коэффициент ее диссоциации около 1500° не менее 0,01. — Малляр и Ле Шателье, изучая скорость охлаждения после взрыва смеси 2 об. СО + 1 об. О в бомбе, находят, что в этих условиях (т. е. при увеличенном давлении) диссоциация СО2 начинает делаться заметной лишь около 2000°, а именно: при этой температуре и давлении в 6 атмосфер коэффициент ее менее 0,05, а при 3300° и 10 атмосферах — около 0,34. Эттинген и Гернет (в Дерпте), с помощью вращающегося зеркала Витстона и фотографирования, наблюдали изображение световых явлений, сопровождающих взрыв смеси 2 об. Н + 1 об. О в вертикально поставленном эвдиометре, внутренние стенки которого, для сообщения яркости пламени, покрывались очень тонким слоем хлористой меди или окиси олова. Полученные снимки (фиг. 4) показывают волнообразное движение собственно накаленных частичек солей, но не самый процесс взрыва, вследствие чего тотчас за изображением искры s получается пустая полоса, и лишь затем начинается отпечаток волн, идущих то вверх, то вниз; nebfcgh — главная волна, nmli — побочная волна, при дальнейшем движении сливающаяся с главной.Фиг. 4. Схематическое изображение волн при взрыве H2 + О: nebfcgh — отпечаток главной волны; nmli — отпечаток побочной волны.Главная волна есть результат взрывной волны, как это явствует из определения ее скорости (около 2600 метров); побочная же волна есть результат диссоциации, т. е. некоторая часть гремучего газа при возвышенной температуре, развиваемой взрывом, остается несоединенной, и за первой волной, по мере охлаждения, возникает вторая волна [По мнению Этингена и Гернета, эти двоякого рода волны подтверждают высказанное еще Бунзеном заключение, что общий взрыв гремучего газа слагается из нескольких частных, следующих друг за другом, а именно: что при взрыве 2 об. Н + 1 об. О и 2 об. СО + 1 об. О, в первый момент лишь 1/3 смеси вступает в соединение, остальные же 2/3 соединяются по мере охлаждения, притом не непрерывным образом, а скачками, так что, напр., для системы 2 об. СО + 1 об. О, развивающей при взрыве температуру 3033°, количество соединившихся газов остается равным 1/3, пока температура охлаждением не понизится до 2558°, и только ниже этой температуры наступает вторая фаза горения, после охлаждения до 1146° — третья и т. д. Но этот вывод Бунзена не раз оспаривался, как основанный, с одной стороны, на неточно измеренных давлениях при взрыве, и с другой — на гипотезе неизменяемости теплоемкости газов при высоких температурах, положенной в основу способа расчета.]. Исходя из результатов С.-Клер-Девиля, что при давлении = 1 атм. и температуре = 3000° коэффициент диссоциации СО2 = 0,40, Ле Шателье ("Zeitschr. für physik. Chemie", Bd. 2, S. 782), при помощи уравнений, управляющих химическими равновесиями (см. это слово), вычислил кривые, показывающие, как изменяется этот коэффициент в зависимости от температуры при изменении давления от 0,001 до 100 атм. (фиг. 5).Фиг. 5. Кривые, показывающие изменение коэффициента диссоциации СО2 с температурой и давлением.Сравнение вычисленных коэффициентов диссоциации с опытными их величинами показывает достаточное согласие:--------------------------------------------------------------------------------------------------------------| | | Коэффициенты диссоциации || Температура | Давление |----------------------------------------------------------|| | | вычисленные | опытные ||------------------------------------------------------------------------------------------------------------|| 1300° | 1 атм. | 0,003 | 0,002 ||------------------------------------------------------------------------------------------------------------|| 1500° | 1 атм. | 0,008 | 0,010 ||------------------------------------------------------------------------------------------------------------|| 2000° | 6 атм. | 0,035 | 0,050 ||------------------------------------------------------------------------------------------------------------|| 3300° | 10 атм. | 0,270 | 0,340 |--------------------------------------------------------------------------------------------------------------На основали приведенных данных должно заключить, что при всех газовых взрывах, в которых температура не превосходит 2000°, диссоциацией можно пренебречь, и тогда вышеприведенная формула достаточно определяет максимальные температуры по воздушному термометру. Если же диссоциацией нельзя пренебречь, то формула для вычисления температур горения получает более сложный вид:T = 273[p/H×1/(1 — δ + δg) — 1]где P — максимальное давление, H — начальное давление при 0°, δ — пропорция действительно соединенных газов, g — отношение объемов продуктов горения и первоначальной смеси (сжатие). Когда величина δ неизвестна, эта формула может определять только пределы. между которыми содержится действительная температура Т, а именно: высший предел при предположении полного сгорания (δ = 1) и низший — при полной диссоциации (δ = 0). Эти пределы будут тем теснее, чем ближе отношение g к единице. Последнее имеет место при взрыве значительно разведенных гремучих смесей, и оттого для них рассматриваемая формула дает довольно близкие к действительности величины Т, независимо от диссоциации.Возвращаясь к вопросу о теплоемкости газов, предположим, что вычислены температуры Т для каждой исследованной взрывчатой смеси по максимальным давлениям, исправленным на охлаждение во время возрастания их при взрыве, а также — пусть даны нам теплоты горения тех же смесей при постоянном объеме Q, в мал. калориях; тогда имеет место уравнение:Q = (mc + m'c' +.. .)Тгде m, т' — количества образовавшихся продуктов, а с, с' — средние теплоемкости этих продуктов при нагревании в постоянном объеме от 0° до Т.Если количество тепла Q отнесено к граммовым частичным весам газов, образующих начальную смесь, то члены, входящие во вторую часть уравнения, выразятся соответственно через nωc, n'ω'c'..., где n, n'... — суть числа молекул продуктов горения, ω, ω'.. . — молекулярные веса их, а ωс, ω'с'... — так называемые средние молекулярные теплоемкости. Такие именно средние молекулярные теплоемкости и подлежали определению в рассматриваемых исследованиях.Малляр и Ле-Шателье подобным способом получили, напр:--------------------------------------------------------------------------------------------------------------------------------------------| Содержание СО + O | Содержание других газов | Температура горения ||-------------------------------------------------------------------------------------------------------------------------------------------|| 0,375 | 0,605 CO2 + 0,02 Н2О | 2025° ||-------------------------------------------------------------------------------------------------------------------------------------------|| 0,350 | 0,630 CO2 + 0,02 Н2О | 1880° ||-------------------------------------------------------------------------------------------------------------------------------------------|| Содержание Н2 + О | Содержание других газов | Температура горения ||-------------------------------------------------------------------------------------------------------------------------------------------|| 0,492 | 0,490 О + 0,018 Н2O | 2190° ||-------------------------------------------------------------------------------------------------------------------------------------------|| 9,392 | 0,485 Н + 0,023 Н2O | 2160° |--------------------------------------------------------------------------------------------------------------------------------------------Полученные данные приводят к следующим выводам: 1) Теплоемкости постоянных газов (О, Н, N и СО), равные при обыкновенной темпер., равны между собою и при 2000°, ибо равные объемы СО, Н2, О2 и N2, прибавленные к гремучей смеси, дают одну и ту же температуру.2) На основании опытов, в которых взрывалась смесь 2 об. СО + 1 об. О, а примешанный газ состоял из CO2, средняя молекулярная теплоемкость при постоянном объеме углекислого газа между 0° и 2000° равна 13,2 малым калориям.8) При помощи этого числа и на основании опытов, в которых к оксиуглеродной гремучей смеси был подмешан азот, теплоемкость азота между 0° и 2000° равна 7,5 мал. калорий. Очевидно, то же число выражает молекулярную теплоемкость и других постоянных газов.4) Наконец, при помощи смесей, в которых постоянные газы примешаны к водородному гремучему газу, вычисляется теплоемкость водяного пара 12,8 мал. калорий, в тех же пределах температуры.5) Так как при обыкновенной температуре для нагревания на 1° в постоянном объеме требуется меньше тепла, напр., для постоянных газов только 4,8 мал. калорий, то, значит, теплоемкости вообще растут с температурою.6) Если таким же образом вычислить теплоемкости и для других температур горения ниже 2000°, получавшихся при взрывах, то результаты выражаются интерполяционными формулами простого вида:а) Средние молекулярные теплоемкости Н2, N2, О2 и СО (т. е. произведение теплоемкости при постоянном объеме на частичный вес) возрастают с температурою по формуле:сv = 4,8 + 0,0006Т.б) Возрастание молекулярной теплоемкости водяного пара следует формуле:Сv = 5,61 + 0,0033Т.в) Для углекислого газа сначала авторы вывели формулуCv = 6,3 + 6,0Т × 10 — 3 — 1,18Т2 × 10 — 6дающую максимум при 2540°, но впоследствии заменили ее более простою:Сv = 6,26 + 0,0037Т.Бертело и Вьейль, распространившие свои исследования до более высоких температур, выразили свои результаты формулами, дающими более высокие значения теплоемкостей; напр. для углекислоты:Сv = 19,1 + 0,0015(Т — 2000°)по которой при T = 2000° Сv = 19,1 (вместо 13,6 по Малляру и Ле Шателье). Это разногласие объясняется, с одной стороны, недостаточным принятием во внимание охлаждения в опытах Бертело и Вьейля, а с другой — тем, что здесь подразумеваются так называемые кажущиеся теплоемкости, заключающие в себе, кроме теплоты, потребной собственно на нагревание, также и теплоту, поглощаемую диссоциацией. Действительно, числа, полученные Вьейлем для постоянных газов при первых его опытах и исправленные на охлаждение более совершенным способом, почти не отличаются от чисел Малляра и Ле Шателье. Н. С. Курнаков (профессор Горного института в С.-Петербурге), вводя поправки на диссоциацию при вычислении теплоемкостей углекислоты на основании вышеприведенных кривых Ле Шателье, показал, что эти теплоемкости, хотя и не достигают величин Малляра и Ле Шателье, но все-таки значительно уменьшаются ("Журнал русского химического общества", том XXII, стр. 493):--------------------------------------------------------------------------------------------------| T | Кажущаяся С по | Коэффициент | Действит. С || | Бертело | диссоциации | ||------------------------------------------------------------------------------------------------|| 2000° | 19,1 | 0,035 | 18,3 ||------------------------------------------------------------------------------------------------|| 2500° | 19,8 | 0,140 | 17,1 ||------------------------------------------------------------------------------------------------|| 3000° | 20,6 | 0,300 | 15,7 ||------------------------------------------------------------------------------------------------|| 3500° | 21,3 | 0,400 | 15,5 ||------------------------------------------------------------------------------------------------|| 4500° | 22,8 | 0,600 | 16,0 |--------------------------------------------------------------------------------------------------Примечательно, что исправленные средние теплоемкости СО2 показывают максимум около 2000° — замечание, высказанное мною еще ранее на основании опытов со взрывчатыми веществами (см. это слово).Изложенные выводы о средних теплоемкостях газов при возвышенной температуре далеко еще неокончательные, особенно для постоянных газов, так как: 1) в момент максимума давления (а следовательно, и температуры) вследствие замедления реакций всегда возможно присутствие части газов, не успевших еще сгореть (наблюдения Клерка); 2) каким бы способом ни производилась поправка на охлаждение стенками бомбы, получение истинной величины ее представляет весьма большие трудности; 3) определения теплоемкостей постоянных газов у Малляра и Ле Шателье сделаны при помощи теплоемкости СО2, т. е. не прямым путем, а в таких определениях суммируются все возможные погрешности.V) Взрывы смесей светильного газа с воздухом. В настоящее время эти взрывы имеют большое применение в газовых двигателях, которые все более и более вытесняют небольшие паровые машины (до 20 лошадиных сил). Состав обычного каменноугольного светильного газа колеблется около следующего:------------------------------------------------------------------| Водорода | 51,08 ||----------------------------------------------------------------|| Болотного газа | 29,26 ||----------------------------------------------------------------|| Окиси углерода | 10,20 ||----------------------------------------------------------------|| Других углеводородов | 4,26 ||----------------------------------------------------------------|| Углекислоты | 2,92 ||----------------------------------------------------------------|| Кислорода | 0,22 ||----------------------------------------------------------------|| Азота | 2,06 ||----------------------------------------------------------------|| | 100,00 |------------------------------------------------------------------Смеси с воздухом, рассчитанные как раз на полное сгорание, содержат около 17,5% светильного газа, или на 1 об. его 4,5 об. воздуха; при употреблении избытка того или другого из них электрическая искра не производит воспламенения, когда объемы светильного газа и воздуха относятся между собою как 1/15 или 1/3 (Клерк). Пропорция, наиболее пригодная для применения в газовых двигателях: на 1 объем газа от 9 до 11 объем. воздуха. По опытам Малляра и Ле Шателье, скорости распространения горения в этих смесях изменяются следующим образом:--------------------------------------------------------| Объемы воздуха на | Скорости в м || 1 об. газа. | в сек. ||-------------------------------------------------------|| 7 об. | 0,83 ||-------------------------------------------------------|| 5,6 " | 1,00 ||-------------------------------------------------------|| 4,7 " | 1,16 ||-------------------------------------------------------|| 4,0 " | 0,90 |--------------------------------------------------------По Михельсону, нормальные скорости меньше этих величин в отношении 5/3. Но данные всех исследователей показывают, что максимум скорости лежит около смешения в пропорции для полного горения и лишь весьма немного подвинут в сторону смесей с избытком светильного газа.Нижеследующая таблица содержит результаты, полученные Клерком при измерении давлений:Светильный газ глазговский, начальная температура смесей = 18°, давление = 1 атм--------------------------------------------------------------------------------------------------------------------------------| Пропорция светильного газа | Максимум | Максимум | Продолжит. || по объему | давления | температуры | взрыва. ||-------------------------------------------------------------------------------------------------------------------------------|| 1/14 | 4,54 мм | 1047° | 0,28 сек. ||-------------------------------------------------------------------------------------------------------------------------------|| 1/12 | 5,29 " | 1265° | 0,18 " ||-------------------------------------------------------------------------------------------------------------------------------|| 1/10 | 5,69 " | 1384° | 0,13 " ||-------------------------------------------------------------------------------------------------------------------------------|| 1/8 | 7,05 " | 1780° | 0,07 " ||-------------------------------------------------------------------------------------------------------------------------------|| 1/6 | 7,53 " | 1918° | 0,05 " |--------------------------------------------------------------------------------------------------------------------------------При дальнейшем увеличении пропорции светильного газа наступает уменьшение давлений и температуры. След., максимальное давление по мере приближения к пределам воспламеняемости уменьшается, а продолжительность взрыва увеличивается. Соответственно давлениям изменяются и температуры. При вычислении их по воздушному термометру, некоторая неопределенность в составе газов (вследствие неполноты сгорания) в момент достижения максимума давления здесь не может привести к значительной ошибке, так как сокращение объема смесей при превращении в окончательную систему продуктов горения незначительно. В самом деле, 100 об. глазговского газа требуют для сжигания 123 об. кислорода; 223 об. смеси превращаются в 199 об. газообразных продуктов горения, т. е. сокращение объема около 10%. Но 1 об. кислорода при сожигании соответствует приблизительно 5 об. воздуха, или 100 об. смеси с воздухом дадут 96,6 об. продуктов горения. Очевидно, максимум ошибки при вычислении температур даже для смесей, не содержащих избытка составных частей, не более 3,4%. Смеси, предварительно сжатые, дают при взрыве давления, пропорциональные их начальным давлениям до воспламенения, т. е., если при том же составе и той же температуре последнее было вдвое больше атмосферного, то и первое увеличится в таком же отношении. В газовых двигателях взрывчатая смесь или не сжимается перед воспламенением, или подвергается предварительному сжатию. Фиг. 6 представляет диаграмму для машины первого типа: смесь воспламеняется при обыкновенном атмосферном давлении; продолжительность взрыва около 1/25 секунды; максимум температуры при взрыве 1750°; температура при конце расширения около 1000°.Фиг. 6. Диаграмма газового двигателя без предварительного сжатия.Если бы не было потери тепла через стенки, то линия давлений (обозначенная пунктиром) при расширении газов, имеющих ту же температуру, т. е. адиабата, прошла бы выше действительной линии. Фиг. 7 изображает диаграмму для машин второго типа: линия 1 — 2 чертится острием индикатора, когда давление на поршень равно нулю; линия 2 — 5 отвечает сжатию смеси перед воспламенением; восходящая линия 5,6 производится взрывом; часть кривой 6 — 7 соответствует расширению до момента открывания клапана; а часть 7 — 8 — падению давлений до атмосферного при открытом клапане, и, наконец, линия, 8 — 1 проводится острием во время возвращения поршня к первоначальному положению.Фиг. 7. Диаграмма газового двигателя с предварительным сжатием.Продолжительность взрыва при этом от 1/20 до 1/30 секунды; максимум температуры около 1700°, и температура газов в конце расширения (при открывании клапана) выше 1100°. Фиг. 8 представляет результаты употребления в газовых двигателях (с предварительным сжатием) смесей постепенно возрастающего разведения: диаграмма а соответствует такому разведению, когда вследствие медленности горения скорость движения поршня больше скорости распространения пламени в цилиндре.Фиг. 8. Диаграмма газового двигателя с возрастающим разведением.В нормальной диаграмме (рис. 7) линия расширения газов проходит значительно выше адиабаты. Последнее обстоятельство, по мнению Клерка, обуславливается тем, что при максимуме температуры, часть газов не успевает сгореть и догорает лишь во время охлаждения, — подобно тому, как это наблюдается при взрыве в запертых сосудах. Точно таким же образом происходит горение и в газовых двигателях без предварительного сжатия: расположение линии расширения зависит главным образом от быстроты охлаждения. Если охлаждение слишком велико, то, несмотря на быструю передачу тепла газам, эта линия может расположиться ниже адиабаты; если же охлаждение ослаблено, она пойдет выше адиабаты.И. М Чельцов. Δ.
Фиг. 2. Прерыватель для подачи сигналов при взрыве (разрез по оси трубок). ТТ — трубки; ss — оловянные полоски; сс — оправы для зажимания; l — место для прикрепления гремучей ртути.Промежуток времени между двумя перерывами измерялся с помощью хронографа Ле Буланже, соединенного проводниками с оловянными полосками. Воспламенение сообщалось посредством сильной электрической искры. Бертело и Вьейль, употребляя различные газовые смеси и меняя условия, описанным способом получили следующие результаты: а) скорость распространения взрывной волны несравненно превосходит скорость постепенного горения, не зависит от материала трубок и представляет для каждого гремучего газа совершенно определенную и характерную величину. Так, для смеси, 2 об. Н + 1 об. О, она равна 2810 м в секунду, для 2 об. СО + 1 об. О — 1100 м, для 2 об. СН4 + 4 об. О — 2290 метров и т. п.; б) скорости взрывных волн, подобно скорости звука, не зависят от начального давления: в) характерные для каждой смеси наибольшие скорости, при воспламенении электрической искрой, получаются не сразу, а лишь после того, как взрывы передвигаются на некоторое расстояние от места воспламенения; напр., для смеси 2 об. Н + об. О лишь после передвижения на 1/2 метра скорость достигает постоянной величины (в пределах погрешностей измерений). Это расстояние увеличивается с ослаблением силы воспламеняющей искры и с уменьшением диаметра трубок ниже 2 миллиметров; г) примешивание какого-либо постороннего газа к гремучей смеси уменьшает скорость взрывной волны, и если разведение достигает значительных пределов, то она совсем прекращается.------------------------------------------------------------------------------------| Смеси. | Скорости волн ||-----------------------------------------------------------------------------------|| 2 об. Н + 1 об. O + 2 об. N | 2121 м ||-----------------------------------------------------------------------------------|| 2 " Н + 4,7 " воздуха | 1439 " ||-----------------------------------------------------------------------------------|| 2 " Н + 6,6 " " | 1205 " ||-----------------------------------------------------------------------------------|| 2 " Н + 7,2 " " | волны нет |------------------------------------------------------------------------------------Пределы состава смесей, вне которых взрывные волны перестают распространяться, гораздо уже пределов воспламеняемости. Весьма вероятно, что эти пределы могут отчасти раздвинуться при употреблении для воспламенения значительных доз гремучей ртути. Постоянство скоростей распространения взрывных волн и зависимость их лишь от состава гремучих смесей Бертело объясняет на основании связи их с температурами, которые развиваются при горении. Хотя вычисление этих температур сомнительно вследствие диссоциации систем и неизвестности теплоемкостей газов при высоких температурах, но, находя их в предположении отсутствия диссоциации и неизменяемости атомной теплоемкости при постоянном давления (3, 4) и вычисляя средние скорости поступательного движения газообразных продуктов горения по формуле Клаузиуса 29,354√(τ/ρ) оказывается, что эти скорости близки к скоростям распространения взрывных волн:--------------------------------------------------------------------------------------------------------------| Смеси | Вычисл. скорость | Скор. взрывных || | частиц | волн. ||------------------------------------------------------------------------------------------------------------|| 2 об. Н + 1 об. О | 2831 м | 2810 м ||------------------------------------------------------------------------------------------------------------|| 2 " СО + 1 " О | 1941 " | 1100 " ||------------------------------------------------------------------------------------------------------------|| 2 " ОН4 + 4 " О | 2427 " | 2287 " |--------------------------------------------------------------------------------------------------------------Если же это действительно так, то понятно, что скорость взрывной волны не может быть больше скорости поступательного движения частиц при данной температуре и что причины, производящие охлаждение, должны уменьшать скорость волны в том же отношении, как и скорость частичных движений сгорающих слоев, что и замечается в действительности. Результаты, полученные Бертело и Вьейлем, были подтверждены Диксоном (в Манчестере); но этот исследователь, кроме того, показал, что скорость взрывной волны в 2 об. СО + 1 об. О заметно увеличивается с влажностью смеси: не совсем сухая смесь дает скорость 1264 м, а насыщенная при 35° водяным паром — 1738 м в секунду. Вероятно, что с увеличением количества водяного пара, играющего существенную роль в горении окиси углерода, увеличивается быстрота самой реакции окисления, которая и позволяет скорости распространения волны развиться до своей предельной величины, определяемой скоростью поступательного движения продуктов горения.IV. Давления при Г. взрывах были предметом довольно большого числа исследований. Выбирая только важнейшие, должно сказать, что первые сюда относящиеся измерения принадлежат Бунзену. Гремучая смесь вводится в стеклянный цилиндрический сосуд, помещенный над ртутью (рис. 3).Фиг. 3. Эвдиометр Бунзена для определения давлений. Грузы a и b, надавливая через стержень d, уравновешивают упругость газов.Закрыв его пришлифованною стеклянною пластинкою, к которой приклеена еще железная пластинка со стержнем, проходящим сквозь для пропускания искры, помещают на внешнюю пластинку другой стержень d, соединенный с рычагом, носящим подвижные грузы а и b, для производства соответствующего давления; воронка, прижатая на каучуковом кольце к тому же краю стеклянного сосуда, позволяет с помощью небольшого количества воды достигнуть совершенной укупорки введенного газа. Если груз, надавливающий на пластинку, очень велик, то взрыв происходит без всякого звука и вода в воронке остается спокойною; если же он очень мал, то слышится звук и вода выбрасывается. Очевидно, меняя грузы, можно довольно точно найти такой, который только едва уравновешивает давление газов при взрыве и который поэтому будет мерою последнего. Описанным способом Бунзен нашел, что 2 об. Н + 1 об. О развивают при взрыве 9,6 атм., 2 об. СО + 1 об. О дают 10,3 атм., и т. п. Способ Бунзена, по опытам Малляра и Ле Шателье, дает погрешности, доходящие до 10%. Более точных результатов эти исследователи достигли с прибором следующего устройства. Камерою для взрыва служил железный цилиндр в 4 литра (с диаметром, равным высоте). Верхнее основание его имело 4 отверстия — одно для проводников, другое для сообщения с воздушным насосом, третье для ртутного манометра, четвертое для введения изучаемых газов, а нижнее основание — только одно отверстие для сообщения с манометром, записывающим давления во время взрыва. С этою целью употреблялся манометр Бурдона, наполняемый водою (для смягчения толчка) и приходящий в движение при возрастании в нем давления; игла, передающая это движение, чертила соответственную кривую давлений на цилиндре, вращающемся со скоростью 1 метра в секунду. Кривые давлений имеют восходящую и нисходящую ветви; первая отвечает периоду распространения взрыва, вторая — охлаждению газов по окончании взрыва. По этим кривым можно было находить законы охлаждения газов и вводить поправки к наблюденным максимальным давлениям для перечисления последних на такие давления, которые получились бы, если бы в период распространения взрыва окружающие стенки не производили никакого охлаждения. Кроме того, изучение охлаждения около максимума давлений позволяло судить, имела ли место диссоциация при взрыве: в этом случае замечается замедление охлаждения, как, например, при взрыве 2 об. СО + 1 об. О, ибо по мере охлаждения все новое количество СО + О переходит в СО2 с отделением тепла. Малляр и Ле Шателье получили: для водородного гремучего газа, содержащего около 4% азота и водяного пара, 9,2 атм., для смеси 2 об. СО + 1 об. О, содержащей 6% азота и водяного пара — 8,6 атм., для смеси 2 об. СН4 + 4 об. 0 — 14 атм. и т. п. При постепенном разбавлении нормальных гремучих смесей другими какими-либо газами, давления уменьшаются также постепенно, а не со скачками, как раньше думал Бунзен на основании своих опытов (менее точных).Метод, подобный описанному, применен был также Клерком ("Chem. News", 63, p. 207) для измерения давлений (индикатором Рихарда) взрывчатых смесей с воздухом; напр.,------------------------------------------------------------------------------------------------------------------------------------------------------------| Состав смеси | Максимум | Продолжит. | ||-------------------------------| давления | взрыва | Падение давления. || Н | возд. | | | ||----------------------------------------------------------------------------------------------------------------------------------------------------------|| 1 об. | 6 об. | 3,8 ат. | 0,150 с. | Спустя 0,065 сек. после максимума ||----------------------------------------------------------------------------------------------------------------------------------------------------------|| 1 " | 4 " | 5,6 " | 0,026 " | Тотчас после достижения максимума ||----------------------------------------------------------------------------------------------------------------------------------------------------------|| 2 " | 5 " | 6,4 " | 0,010 " | Тотчас после достижения максимума |------------------------------------------------------------------------------------------------------------------------------------------------------------Более продолжительное удерживание максимума давления разбавленными смесями дает повод заключить, что диссоциация не есть единственная причина, ограничивающая возрастание и падение давлений при газовых взрывах. По мнению Клерка, горение подобно другим обратимым реакциям, т. е. сначала протекает очень быстро и по мере приближения к концу замедляется; а в таком случае максимум давления отвечает такому состоянию системы, когда скорость охлаждения равна скорости доставления тепла; другими словами — горение продолжается и после достижения максимума давления. Бертело и Вьейль применяли для измерения давлении при газовых взрывах способ, основанный на изучении закона движения поршня определенного сечения и массы. Опыты производились в бомбах (подобных описанным в соотв. статье), емкостью в 0,300, 1,500 и 4,000 л. Наиболее высокие давления получаются, когда в роли горючего газа взяты углеводороды, болотный газ СН4, маслородный газ С2Н4, ацетилен С2H2, метиловый эфир (СН3)2O и циан C2N2, а сожигающим газом служат окислы азота NO и N2O. Так, для смеси 2 об. СН4 + 4 об. О, взятой при нормальных условиях, давление равно 16,34 атм., смесь 2 об. C2N2 + 4 об. О дает 20,96 атм., 2 об. С2N2 + 8 об. N2O — 22,66 атм. и т. п.Изучение давлений при Г. взрывах дает возможность судить о теплоемкостях газов при высоких температурах. Если принять, что все газы при высокой температуре следуют законам Мариотта и Гей-Люссака, то из наблюденного при взрыве давления Р можно вывести температуру горения Т по воздушному термометру, ибоТ/t0 = Р/Рогде t0 есть 0°, или обыкновенная температура, а р0 — окончательное давление продуктов взрыва при этой температуре (считая и воду газообразной). Но приведенное уравнение имеет место лишь при условии, что при взрыве не происходит диссоциации образующихся газов, поэтому предварительно следует уяснить, когда и в какой мере это действительно можно принять.С.-Клер-Девиль доказал качественно диссоциацию водяного пара и углекислого газа выше 1000°; в то же время, применяя свой метод быстрого охлаждения (см. Диссоциация), показал для СО2, что коэффициент ее диссоциации под обыкновенным давлением около 1300° равен почти 0,002, а при температуре горения смеси окиси углерода с кислородом (по Малляру и Ле Шателье около 3000°) равен приблизительно 0,40. Крафтс, на основании определения расширения СО2 при высоких температурах, заключил, что коэффициент ее диссоциации около 1500° не менее 0,01. — Малляр и Ле Шателье, изучая скорость охлаждения после взрыва смеси 2 об. СО + 1 об. О в бомбе, находят, что в этих условиях (т. е. при увеличенном давлении) диссоциация СО2 начинает делаться заметной лишь около 2000°, а именно: при этой температуре и давлении в 6 атмосфер коэффициент ее менее 0,05, а при 3300° и 10 атмосферах — около 0,34. Эттинген и Гернет (в Дерпте), с помощью вращающегося зеркала Витстона и фотографирования, наблюдали изображение световых явлений, сопровождающих взрыв смеси 2 об. Н + 1 об. О в вертикально поставленном эвдиометре, внутренние стенки которого, для сообщения яркости пламени, покрывались очень тонким слоем хлористой меди или окиси олова. Полученные снимки (фиг. 4) показывают волнообразное движение собственно накаленных частичек солей, но не самый процесс взрыва, вследствие чего тотчас за изображением искры s получается пустая полоса, и лишь затем начинается отпечаток волн, идущих то вверх, то вниз; nebfcgh — главная волна, nmli — побочная волна, при дальнейшем движении сливающаяся с главной.Фиг. 4. Схематическое изображение волн при взрыве H2 + О: nebfcgh — отпечаток главной волны; nmli — отпечаток побочной волны.Главная волна есть результат взрывной волны, как это явствует из определения ее скорости (около 2600 метров); побочная же волна есть результат диссоциации, т. е. некоторая часть гремучего газа при возвышенной температуре, развиваемой взрывом, остается несоединенной, и за первой волной, по мере охлаждения, возникает вторая волна [По мнению Этингена и Гернета, эти двоякого рода волны подтверждают высказанное еще Бунзеном заключение, что общий взрыв гремучего газа слагается из нескольких частных, следующих друг за другом, а именно: что при взрыве 2 об. Н + 1 об. О и 2 об. СО + 1 об. О, в первый момент лишь 1/3 смеси вступает в соединение, остальные же 2/3 соединяются по мере охлаждения, притом не непрерывным образом, а скачками, так что, напр., для системы 2 об. СО + 1 об. О, развивающей при взрыве температуру 3033°, количество соединившихся газов остается равным 1/3, пока температура охлаждением не понизится до 2558°, и только ниже этой температуры наступает вторая фаза горения, после охлаждения до 1146° — третья и т. д. Но этот вывод Бунзена не раз оспаривался, как основанный, с одной стороны, на неточно измеренных давлениях при взрыве, и с другой — на гипотезе неизменяемости теплоемкости газов при высоких температурах, положенной в основу способа расчета.]. Исходя из результатов С.-Клер-Девиля, что при давлении = 1 атм. и температуре = 3000° коэффициент диссоциации СО2 = 0,40, Ле Шателье ("Zeitschr. für physik. Chemie", Bd. 2, S. 782), при помощи уравнений, управляющих химическими равновесиями (см. это слово), вычислил кривые, показывающие, как изменяется этот коэффициент в зависимости от температуры при изменении давления от 0,001 до 100 атм. (фиг. 5).Фиг. 5. Кривые, показывающие изменение коэффициента диссоциации СО2 с температурой и давлением.Сравнение вычисленных коэффициентов диссоциации с опытными их величинами показывает достаточное согласие:--------------------------------------------------------------------------------------------------------------| | | Коэффициенты диссоциации || Температура | Давление |----------------------------------------------------------|| | | вычисленные | опытные ||------------------------------------------------------------------------------------------------------------|| 1300° | 1 атм. | 0,003 | 0,002 ||------------------------------------------------------------------------------------------------------------|| 1500° | 1 атм. | 0,008 | 0,010 ||------------------------------------------------------------------------------------------------------------|| 2000° | 6 атм. | 0,035 | 0,050 ||------------------------------------------------------------------------------------------------------------|| 3300° | 10 атм. | 0,270 | 0,340 |--------------------------------------------------------------------------------------------------------------На основали приведенных данных должно заключить, что при всех газовых взрывах, в которых температура не превосходит 2000°, диссоциацией можно пренебречь, и тогда вышеприведенная формула достаточно определяет максимальные температуры по воздушному термометру. Если же диссоциацией нельзя пренебречь, то формула для вычисления температур горения получает более сложный вид:T = 273[p/H×1/(1 — δ + δg) — 1]где P — максимальное давление, H — начальное давление при 0°, δ — пропорция действительно соединенных газов, g — отношение объемов продуктов горения и первоначальной смеси (сжатие). Когда величина δ неизвестна, эта формула может определять только пределы. между которыми содержится действительная температура Т, а именно: высший предел при предположении полного сгорания (δ = 1) и низший — при полной диссоциации (δ = 0). Эти пределы будут тем теснее, чем ближе отношение g к единице. Последнее имеет место при взрыве значительно разведенных гремучих смесей, и оттого для них рассматриваемая формула дает довольно близкие к действительности величины Т, независимо от диссоциации.Возвращаясь к вопросу о теплоемкости газов, предположим, что вычислены температуры Т для каждой исследованной взрывчатой смеси по максимальным давлениям, исправленным на охлаждение во время возрастания их при взрыве, а также — пусть даны нам теплоты горения тех же смесей при постоянном объеме Q, в мал. калориях; тогда имеет место уравнение:Q = (mc + m'c' +.. .)Тгде m, т' — количества образовавшихся продуктов, а с, с' — средние теплоемкости этих продуктов при нагревании в постоянном объеме от 0° до Т.Если количество тепла Q отнесено к граммовым частичным весам газов, образующих начальную смесь, то члены, входящие во вторую часть уравнения, выразятся соответственно через nωc, n'ω'c'..., где n, n'... — суть числа молекул продуктов горения, ω, ω'.. . — молекулярные веса их, а ωс, ω'с'... — так называемые средние молекулярные теплоемкости. Такие именно средние молекулярные теплоемкости и подлежали определению в рассматриваемых исследованиях.Малляр и Ле-Шателье подобным способом получили, напр:--------------------------------------------------------------------------------------------------------------------------------------------| Содержание СО + O | Содержание других газов | Температура горения ||-------------------------------------------------------------------------------------------------------------------------------------------|| 0,375 | 0,605 CO2 + 0,02 Н2О | 2025° ||-------------------------------------------------------------------------------------------------------------------------------------------|| 0,350 | 0,630 CO2 + 0,02 Н2О | 1880° ||-------------------------------------------------------------------------------------------------------------------------------------------|| Содержание Н2 + О | Содержание других газов | Температура горения ||-------------------------------------------------------------------------------------------------------------------------------------------|| 0,492 | 0,490 О + 0,018 Н2O | 2190° ||-------------------------------------------------------------------------------------------------------------------------------------------|| 9,392 | 0,485 Н + 0,023 Н2O | 2160° |--------------------------------------------------------------------------------------------------------------------------------------------Полученные данные приводят к следующим выводам: 1) Теплоемкости постоянных газов (О, Н, N и СО), равные при обыкновенной темпер., равны между собою и при 2000°, ибо равные объемы СО, Н2, О2 и N2, прибавленные к гремучей смеси, дают одну и ту же температуру.2) На основании опытов, в которых взрывалась смесь 2 об. СО + 1 об. О, а примешанный газ состоял из CO2, средняя молекулярная теплоемкость при постоянном объеме углекислого газа между 0° и 2000° равна 13,2 малым калориям.8) При помощи этого числа и на основании опытов, в которых к оксиуглеродной гремучей смеси был подмешан азот, теплоемкость азота между 0° и 2000° равна 7,5 мал. калорий. Очевидно, то же число выражает молекулярную теплоемкость и других постоянных газов.4) Наконец, при помощи смесей, в которых постоянные газы примешаны к водородному гремучему газу, вычисляется теплоемкость водяного пара 12,8 мал. калорий, в тех же пределах температуры.5) Так как при обыкновенной температуре для нагревания на 1° в постоянном объеме требуется меньше тепла, напр., для постоянных газов только 4,8 мал. калорий, то, значит, теплоемкости вообще растут с температурою.6) Если таким же образом вычислить теплоемкости и для других температур горения ниже 2000°, получавшихся при взрывах, то результаты выражаются интерполяционными формулами простого вида:а) Средние молекулярные теплоемкости Н2, N2, О2 и СО (т. е. произведение теплоемкости при постоянном объеме на частичный вес) возрастают с температурою по формуле:сv = 4,8 + 0,0006Т.б) Возрастание молекулярной теплоемкости водяного пара следует формуле:Сv = 5,61 + 0,0033Т.в) Для углекислого газа сначала авторы вывели формулуCv = 6,3 + 6,0Т × 10 — 3 — 1,18Т2 × 10 — 6дающую максимум при 2540°, но впоследствии заменили ее более простою:Сv = 6,26 + 0,0037Т.Бертело и Вьейль, распространившие свои исследования до более высоких температур, выразили свои результаты формулами, дающими более высокие значения теплоемкостей; напр. для углекислоты:Сv = 19,1 + 0,0015(Т — 2000°)по которой при T = 2000° Сv = 19,1 (вместо 13,6 по Малляру и Ле Шателье). Это разногласие объясняется, с одной стороны, недостаточным принятием во внимание охлаждения в опытах Бертело и Вьейля, а с другой — тем, что здесь подразумеваются так называемые кажущиеся теплоемкости, заключающие в себе, кроме теплоты, потребной собственно на нагревание, также и теплоту, поглощаемую диссоциацией. Действительно, числа, полученные Вьейлем для постоянных газов при первых его опытах и исправленные на охлаждение более совершенным способом, почти не отличаются от чисел Малляра и Ле Шателье. Н. С. Курнаков (профессор Горного института в С.-Петербурге), вводя поправки на диссоциацию при вычислении теплоемкостей углекислоты на основании вышеприведенных кривых Ле Шателье, показал, что эти теплоемкости, хотя и не достигают величин Малляра и Ле Шателье, но все-таки значительно уменьшаются ("Журнал русского химического общества", том XXII, стр. 493):--------------------------------------------------------------------------------------------------| T | Кажущаяся С по | Коэффициент | Действит. С || | Бертело | диссоциации | ||------------------------------------------------------------------------------------------------|| 2000° | 19,1 | 0,035 | 18,3 ||------------------------------------------------------------------------------------------------|| 2500° | 19,8 | 0,140 | 17,1 ||------------------------------------------------------------------------------------------------|| 3000° | 20,6 | 0,300 | 15,7 ||------------------------------------------------------------------------------------------------|| 3500° | 21,3 | 0,400 | 15,5 ||------------------------------------------------------------------------------------------------|| 4500° | 22,8 | 0,600 | 16,0 |--------------------------------------------------------------------------------------------------Примечательно, что исправленные средние теплоемкости СО2 показывают максимум около 2000° — замечание, высказанное мною еще ранее на основании опытов со взрывчатыми веществами (см. это слово).Изложенные выводы о средних теплоемкостях газов при возвышенной температуре далеко еще неокончательные, особенно для постоянных газов, так как: 1) в момент максимума давления (а следовательно, и температуры) вследствие замедления реакций всегда возможно присутствие части газов, не успевших еще сгореть (наблюдения Клерка); 2) каким бы способом ни производилась поправка на охлаждение стенками бомбы, получение истинной величины ее представляет весьма большие трудности; 3) определения теплоемкостей постоянных газов у Малляра и Ле Шателье сделаны при помощи теплоемкости СО2, т. е. не прямым путем, а в таких определениях суммируются все возможные погрешности.V) Взрывы смесей светильного газа с воздухом. В настоящее время эти взрывы имеют большое применение в газовых двигателях, которые все более и более вытесняют небольшие паровые машины (до 20 лошадиных сил). Состав обычного каменноугольного светильного газа колеблется около следующего:------------------------------------------------------------------| Водорода | 51,08 ||----------------------------------------------------------------|| Болотного газа | 29,26 ||----------------------------------------------------------------|| Окиси углерода | 10,20 ||----------------------------------------------------------------|| Других углеводородов | 4,26 ||----------------------------------------------------------------|| Углекислоты | 2,92 ||----------------------------------------------------------------|| Кислорода | 0,22 ||----------------------------------------------------------------|| Азота | 2,06 ||----------------------------------------------------------------|| | 100,00 |------------------------------------------------------------------Смеси с воздухом, рассчитанные как раз на полное сгорание, содержат около 17,5% светильного газа, или на 1 об. его 4,5 об. воздуха; при употреблении избытка того или другого из них электрическая искра не производит воспламенения, когда объемы светильного газа и воздуха относятся между собою как 1/15 или 1/3 (Клерк). Пропорция, наиболее пригодная для применения в газовых двигателях: на 1 объем газа от 9 до 11 объем. воздуха. По опытам Малляра и Ле Шателье, скорости распространения горения в этих смесях изменяются следующим образом:--------------------------------------------------------| Объемы воздуха на | Скорости в м || 1 об. газа. | в сек. ||-------------------------------------------------------|| 7 об. | 0,83 ||-------------------------------------------------------|| 5,6 " | 1,00 ||-------------------------------------------------------|| 4,7 " | 1,16 ||-------------------------------------------------------|| 4,0 " | 0,90 |--------------------------------------------------------По Михельсону, нормальные скорости меньше этих величин в отношении 5/3. Но данные всех исследователей показывают, что максимум скорости лежит около смешения в пропорции для полного горения и лишь весьма немного подвинут в сторону смесей с избытком светильного газа.Нижеследующая таблица содержит результаты, полученные Клерком при измерении давлений:Светильный газ глазговский, начальная температура смесей = 18°, давление = 1 атм--------------------------------------------------------------------------------------------------------------------------------| Пропорция светильного газа | Максимум | Максимум | Продолжит. || по объему | давления | температуры | взрыва. ||-------------------------------------------------------------------------------------------------------------------------------|| 1/14 | 4,54 мм | 1047° | 0,28 сек. ||-------------------------------------------------------------------------------------------------------------------------------|| 1/12 | 5,29 " | 1265° | 0,18 " ||-------------------------------------------------------------------------------------------------------------------------------|| 1/10 | 5,69 " | 1384° | 0,13 " ||-------------------------------------------------------------------------------------------------------------------------------|| 1/8 | 7,05 " | 1780° | 0,07 " ||-------------------------------------------------------------------------------------------------------------------------------|| 1/6 | 7,53 " | 1918° | 0,05 " |--------------------------------------------------------------------------------------------------------------------------------При дальнейшем увеличении пропорции светильного газа наступает уменьшение давлений и температуры. След., максимальное давление по мере приближения к пределам воспламеняемости уменьшается, а продолжительность взрыва увеличивается. Соответственно давлениям изменяются и температуры. При вычислении их по воздушному термометру, некоторая неопределенность в составе газов (вследствие неполноты сгорания) в момент достижения максимума давления здесь не может привести к значительной ошибке, так как сокращение объема смесей при превращении в окончательную систему продуктов горения незначительно. В самом деле, 100 об. глазговского газа требуют для сжигания 123 об. кислорода; 223 об. смеси превращаются в 199 об. газообразных продуктов горения, т. е. сокращение объема около 10%. Но 1 об. кислорода при сожигании соответствует приблизительно 5 об. воздуха, или 100 об. смеси с воздухом дадут 96,6 об. продуктов горения. Очевидно, максимум ошибки при вычислении температур даже для смесей, не содержащих избытка составных частей, не более 3,4%. Смеси, предварительно сжатые, дают при взрыве давления, пропорциональные их начальным давлениям до воспламенения, т. е., если при том же составе и той же температуре последнее было вдвое больше атмосферного, то и первое увеличится в таком же отношении. В газовых двигателях взрывчатая смесь или не сжимается перед воспламенением, или подвергается предварительному сжатию. Фиг. 6 представляет диаграмму для машины первого типа: смесь воспламеняется при обыкновенном атмосферном давлении; продолжительность взрыва около 1/25 секунды; максимум температуры при взрыве 1750°; температура при конце расширения около 1000°.Фиг. 6. Диаграмма газового двигателя без предварительного сжатия.Если бы не было потери тепла через стенки, то линия давлений (обозначенная пунктиром) при расширении газов, имеющих ту же температуру, т. е. адиабата, прошла бы выше действительной линии. Фиг. 7 изображает диаграмму для машин второго типа: линия 1 — 2 чертится острием индикатора, когда давление на поршень равно нулю; линия 2 — 5 отвечает сжатию смеси перед воспламенением; восходящая линия 5,6 производится взрывом; часть кривой 6 — 7 соответствует расширению до момента открывания клапана; а часть 7 — 8 — падению давлений до атмосферного при открытом клапане, и, наконец, линия, 8 — 1 проводится острием во время возвращения поршня к первоначальному положению.Фиг. 7. Диаграмма газового двигателя с предварительным сжатием.Продолжительность взрыва при этом от 1/20 до 1/30 секунды; максимум температуры около 1700°, и температура газов в конце расширения (при открывании клапана) выше 1100°. Фиг. 8 представляет результаты употребления в газовых двигателях (с предварительным сжатием) смесей постепенно возрастающего разведения: диаграмма а соответствует такому разведению, когда вследствие медленности горения скорость движения поршня больше скорости распространения пламени в цилиндре.Фиг. 8. Диаграмма газового двигателя с возрастающим разведением.В нормальной диаграмме (рис. 7) линия расширения газов проходит значительно выше адиабаты. Последнее обстоятельство, по мнению Клерка, обуславливается тем, что при максимуме температуры, часть газов не успевает сгореть и догорает лишь во время охлаждения, — подобно тому, как это наблюдается при взрыве в запертых сосудах. Точно таким же образом происходит горение и в газовых двигателях без предварительного сжатия: расположение линии расширения зависит главным образом от быстроты охлаждения. Если охлаждение слишком велико, то, несмотря на быструю передачу тепла газам, эта линия может расположиться ниже адиабаты; если же охлаждение ослаблено, она пойдет выше адиабаты.И. М Чельцов. Δ.
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — С.-Пб.: Брокгауз-Ефрон. 1890—1907.