- Сжижение газов
-
не могло бы считаться вполне изученным, если бы не были получены недавно Дьюаром в жидком виде наиболее трудно сгущаемые из них, а именно водород и гелий. В ст. Газы сжиженные (см.) приведена история вопроса о С. газов и уже описано получение Врублевским и Ольшевским кислорода, окиси углерода и азота в жидком виде. Тот же прием был применяем вначале Дьюаром к получению больших количеств кислорода. В 1895 году Дьюар представил Лондонскому химическому обществу новый прибор для С. кислорода; в этом приборе можно было гораздо легче достигать очень низких температур благодаря непрерывному расширению сжатого газа. Здесь необходимо рассмотреть два случая расширения газов: первый, когда происходит быстрое расширение предварительно сильно сжатого газа, сопровождаемое сильным охлаждением; этот прием с успехом применяется в приборе Кальете (см. Газы сжиженные), но нет никакой возможности поддерживать таким путем постоянную, очень низкую температуру. Лишь для незначительного охлаждения при малом сжатии и малом расширении подобного рода машины могут работать производительно (см. Лед искусственный). В рассматриваемом случае происходит преобразование тепловой энергии газа во внешнюю работу; получаемое охлаждение эквивалентно внешней работе (см. Теплота, адиабатический процесс). Гораздо большее значение в усовершенствовании приемов охлаждения имеет другой случай расширения, сопровождающийся охлаждением, это так назыв. явление Джоуля-Томсона. Это явление и было применено Дьюаром и, по-видимому, одновременно с ним и Линде к получению весьма низких температур. Роль этого явления тем более замечательна, что в условиях опытов, которые производились (в 1854 г.) для изучения этого явления, весь эффект заключался в очень незначительном понижении температуры, для воздуха около 0,3° С на атмосферу разности давлений, а для водорода даже в повышении температуры; между тем именно на основании этого явления, правда, при очень низкой температуре, удалось обратить водород в жидкость. Сущность явления Джоуля-Томсона заключается в следующем: газ, выходящий из резервуара, в котором поддерживается постоянное давление р1 и температура Т (по абсолютной шкале), через малые отверстия, напр. пробку из ваты или шелка, в другой резервуар, имеющий, равно как и все части прибора, ту же температуру Т и некоторое постоянное давление р0 , охлаждается. Понижение температуры может быть выраженоθ° = a(p1—p0)(273/T)2где а постоянная, зависящая от свойств взятого газа, равная для воздуха = 0,276, для углекислоты = 1,388, p1 и р0 — давления в атмосферах. Для уяснения явления заметим, что если бы испытуемый газ строго следовал закону Бойля-Мариотта, что характеризовало бы полное отсутствие сцепления между частицами, то охлаждения никаким образом не могло бы быть, а внешняя работа газа равнялась бы при этом расширении нулю. Весь процесс свелся бы тогда на истечение, аналогичное течению воды в водоливе, действие малых отверстий сказалось бы в появлении трения газа о стенки и края отверстий, и результатом должно бы получиться нагревание газа, а не охлаждение. Действительные же газы, как оказывается, обладают сцеплением, особенно при низких температурах, где явление Джоуля-Томсона становится все более и более значительным. Понижение температуры в явлении Джоуля-Томсона можно получить вычислением, пользуясь уравнением состояния, например, Ван-дер Вальса (см. Ваальса формула), и наоборот, исходя из результатов опытов, можно получить новый вид уравнения состояния. При получении весьма низких температур именно и имеет место явление Джоуля-Томсона, которое иногда называют явлением расширения без внешней работы. Фиг. 1 изображает прибор, в котором получается жидкий кислород или воздух.
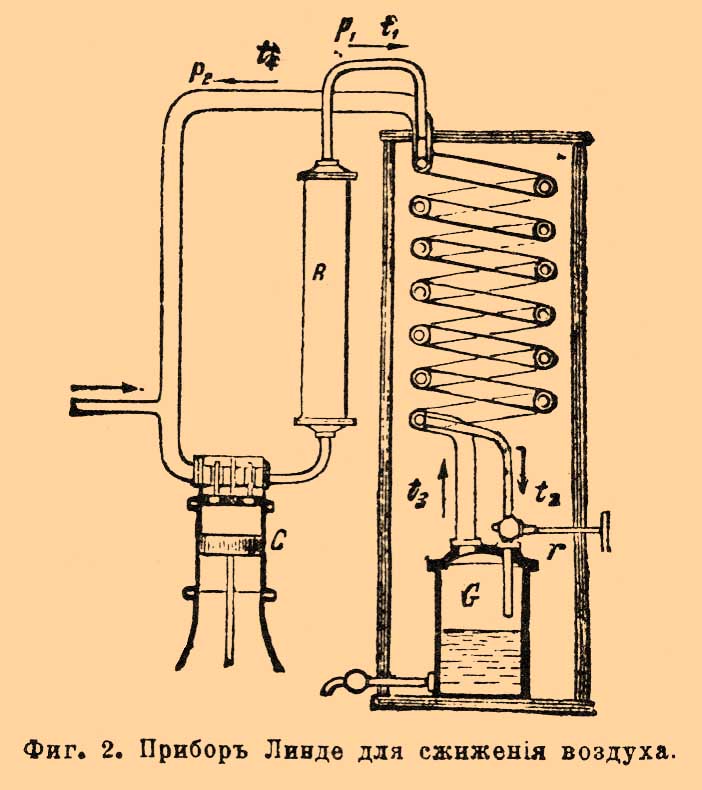
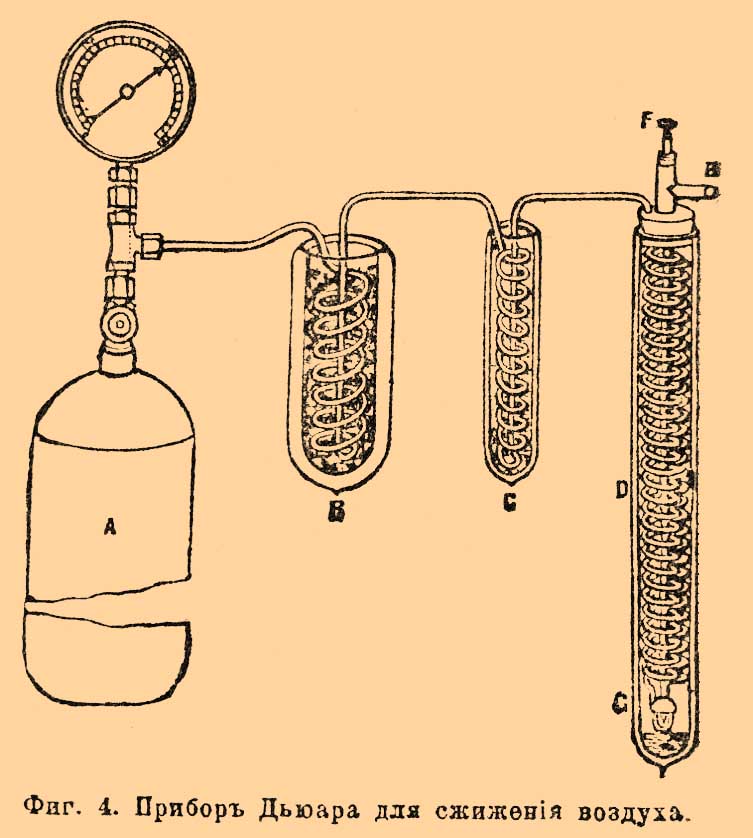
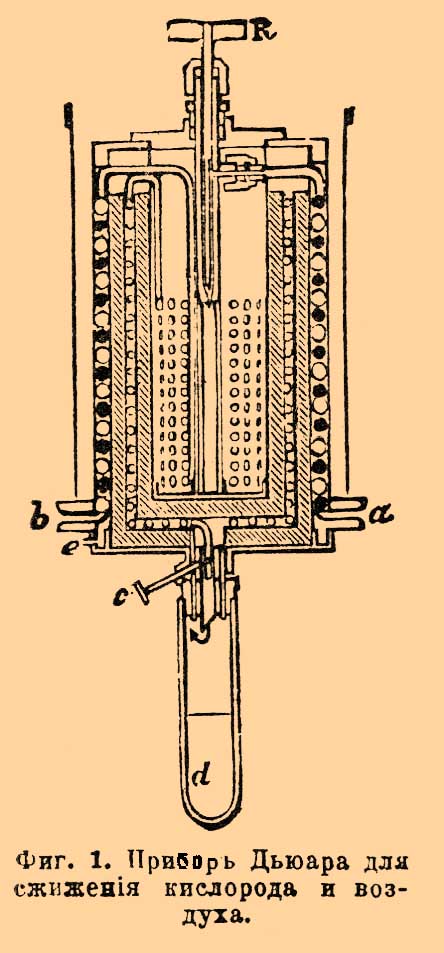 Фиг. 1. Прибор Дьюара для сжижения кислорода и воздуха.В этом приборе кислород охлаждается предварительно до —79° при помощи углекислоты, которая, входя по трубке (из резервуара с жидкой углекислотой, не изображенного на фиг.) через а, проходит в змеевик, изображенный в сечении черными кружками, доходит до клапана R, здесь расширяется, охлаждая все внутреннее помещение, затем проходит между стенками прибора и выходит через отверстие в наружной стенке е. Кислород, сжатый до 100—150 атмосфер в стальном резервуаре, входит по трубке (не изображена) через b в змеевик, изображенный в сечении белыми кружками, охлаждается кипящей углекислотой, проходя по змеевику, проходит между средними стенками к расширительному точному клапану с, здесь, расширяясь, охлаждается и (после некоторого времени действия) обращается в жидкость, стекая на дно сосуда d. Из сосуда d кислород (или после С. пары) проходит мимо змеевика навстречу непрерывно поступающему к клапану с свежему кислороду, охлаждает его перед самым расширением и, наконец, проходит далее, между наружными стенками и выходит наружу вместе с углекислотой через е. Нетрудно видеть, что понижение температуры, получающееся при расширении кислорода в клапане с, способствует усиленному охлаждению поступающего вновь кислорода, что вызывает (см. формулу) новое понижение температуры при расширении, и так продолжается до тех пор, пока температура не упадет до температуры кипения кислорода. Весьма существенную часть аппарата представляет сосуд d. Это стеклянный стакан с двойными стенками и с Круксовой (см.) пустотой внутри стенок. Благодаря отсутствию теплопроводности и конвекции он раз в 20 лучше изолирует, чем сосуд без пустоты. Еще более сильная изоляция достигается, если высеребрить стенки внутри стенок, чем уменьшается роль лучеиспускания (Дьюар). Подобный же прибор служит Дьюару и для С. воздуха, но с тою разницей, что испарение углекислоты, служащей для предварительного охлаждения воздуха, происходит под малым давлением 25 мм ртутного столба, когда температура кипения углекислоты = —115° С. Прибор Линдо для С. воздуха представляет значительное преимущество перед прибором Дьюара в том смысле, что не требует предварительного охлаждения, хотя с точки зрения затраты механической работы едва ли может считаться экономичнее. Фиг. 2, схематическая, наглядно объясняет принцип устройства машины Линде.Фиг. 2. Прибор Линде для сжижения воздуха.Воздух накачивается насосом С, где сжимается до давления р1; проходя в холодильник R, этот воздух, сильно разогретый вследствие сжимания в насосе, охлаждается текущей водой до температуры t1 и затем проходит во внутренний змеевик к регулирующему клапану r. Проходя через очень малое отверстие в этом клапане, воздух расширяется от давления p1 до р2 и при этом охлаждается наθ°= 0,276(p1—p2)(273/T)2и затем идет навстречу вновь поступающему из насоса воздуху, проходя по кольцевому пространству наружного змеевика и наконец завершает свой круговорот, вновь поступая в насос. Оба змеевика, внутренний и внешний, свернуты из медных трубок вместе и при этом хорошо изолированы друг от друга; вся система от внешнего притока тепла хорошо изолируется неочищенной шерстью. Когда прибор в действии, воздух охлаждается от t1 до t2 во внутреннем змеевике, затем еще охлаждается вследствие расширения в клапане r от t2 до t3; проходя наружным змеевиком, он охлаждает идущий навстречу воздух, нагреваясь при этом до t4 и вновь поступает в насос. При таком круговороте происходит прогрессивное охлаждение воздуха до его С.; жидкий воздух стекает на дно сосуда G, откуда может быть вылит наружу. Второй насос, помещенный в A, доставляет новое количество воздуха взамен сжиженного. Есть выгода не давать во время действия прибора полного расширения воздуха до атмосф. давления, так как работа, потребная для сжатия воздуха в насосе, пропорциональна log отношения давлений p1/p2 (при изотермическом сжатии, см. Теплота); поэтому желательно по возможности уменьшить это отношение. Так как для надлежащего охлаждения в приборе Линде приходится иметь p1 = около 200 атмосфер, то, давая расширение до атмосферы, имеем это отношение = 200, а дав, например, расширение до 15 атмосфер, мы получим отношение около 13. Взяв логарифмы, мы увидим, что во втором случае потребуется меньше работы почти вдвое. Между тем охлаждение на основании явления Джоуля-Томсона зависит лишь от разности (р1—р2), которая при наших предположениях будет: в первом случае 199, а во втором 185, что не особенно ухудшит действие прибора. Подобное же отношение работ получится и при адиабатическом сжатии, но сама работа в этом случае будет гораздо более, чем при изотермическом сжатии при температуре t; последнее для быстроходного насоса осуществить крайне трудно. Фиг. 3 изображает одну из более поздних моделей и предназначена для лаборатории.Фиг. 3. Прибор Линде для сжижения воздуха.Прибор состоит из насоса с двумя цилиндрами и охлаждающего аппарата, состоящего из трех концентрических змеевиков. Воздух входит прямо из комнаты в насос, все время охлаждаемый текущей водой (кроме того, некоторое количество воды всасывается внутрь в цилиндры) для того, чтобы противодействовать по возможности повышению температуры при сжатии, а также для уменьшения вредных пространств в цилиндрах и пр. В первом цилиндре воздух сжимается до р1 = 16 атмосфер, во втором — от 16 до 200. Сжатый воздух проходит в сепаратор f, где происходит отстаивание воды, которая время от времени удаляется при помощи крана, находящегося внизу f. Из f далее воздух идет в ящик g, где несколько охлаждается смесью снега и соли; при этом пары воды замерзают, и воздух таким образом значительно осушается, что весьма важно, иначе прибор поминутно забивался бы льдом. Затем воздух проходит по внутреннему змеевику внутрь холодильного аппарата; посредством клапана а дают расширение от 200 атм. до 16, охлажденный при этом воздух (клапан b закрыт) по среднему змеевику возвращается назад ко второму цилиндру насоса, снова сжимается до 200 атм. и вновь проходит тот же путь. Некоторое количество воздуха, охлажденного расширением в а, при помощи второго клапана b можно подвергнуть еще расширению от 16 до одной атмосферы; часть этого воздуха (около 5%) при установившемся режиме сжижается, собираясь в сосуде с, остальной воздух, пройдя еще по третьему змеевику (см. фиг.), выходит наружу. Жидкий воздух, собирающийся в сосуде с (описанном при приборе Дьюара), при помощи стеклянной трубки, доходящей до дна сосуда и крана h, может быть выпущен в стеклянные же колбы, имеющие также пустоту внутри двойных стенок. Подобные приборы Линде производят около 1 литра жидкого воздуха в час; при затрате 3 лошадиных сил С. может начаться после 1/2 — 1 часа работы. Машины Триплера и Гампсона также появились около 1895 г. Машина Триплера значительно сложнее машины Линде, она может давать 9—13 литров жидкого воздуха в час. В машине Гампсона воздух сжимается всего до 120 атм. и расширяется прямо до атмосферного давления, расширительный клапан дает отверстие в виде щели, жидкий воздух получается через 16 минут действия и через 1 минуту, если прибор предварительно охлажден при помощи жидкой углекислоты. Получение жидкого воздуха в больших количествах, низкая темп. его кипения при атмосферном давлении (около —180° — —190°С) весьма упростила манипуляции для применения очень низких температур (до —200° С при разрежении). После столь большого успеха оставалось лишь обратить в жидкость водород. Первая серьезная попытка получить водород в виде жидкости была сделана Врублевским в январе 1884 года. Водород, сжатый в капиллярной трубке до 100 атм. и охлажденный до температуры кипения кислорода (—200°С) при мгновенном уменьшении давления до 1 атм. обнаружил явление вроде вскипания, полученное Кальете при опыте с кислородом. Врублевский счел нужным сообщить об этом, когда Ольшевский сообщил о получении им водорода в виде бесцветной жидкости при расширении от 190 атм. и охлаждении жидким кислородом. Но опыты, повторенные Врублевским, не подтвердили этого явления; наоборот, выяснилось, что при подобном методе ввиду крайне непостоянной температуры нельзя с уверенностью говорить о получении жидкости. При самой низкой температуре, которую можно было смерить (около —223° С), водород заведомо не обращался в жидкость. После неудачи получить более низкие температуры Врублевский занялся изучением изотерм (см. Газы сжиженные) водорода, и, имея их, он вычислил коэффициент формулы Ван дер Ваальса и дал такие критические постоянные водорода:----------------------------------------------------------------------------------------------------------------------| По данным: | Врублевского | Ольшевского из опыта 1895 г. ||---------------------------------------------------------------------------------------------------------------------|| Критическая температура | —240° С | —234° С ||---------------------------------------------------------------------------------------------------------------------|| Критическое давление | 13 атм. | 20 атм. ||---------------------------------------------------------------------------------------------------------------------|| Температура кипения | —250° С | —243° С |----------------------------------------------------------------------------------------------------------------------Дальнейшие исследования Ольшевского и Дьюара подтвердили правильность заключений Врублевского и обнаружили очень большую неточность в определении критического давления водорода, получаемого по формуле Сарро, основанной на опытах Амага над сжатием водорода; критическое давление, полученное отсюда, 99 атм., оказалось раза в 4 больше полученного впоследствии (см. Газы в критическом состоянии). Затем работы по С. водорода настойчиво продолжались Ольшевским и Дьюаром независимо друг от друга, но окончательно вопрос был решен Дьюаром в мае 1898 года. Прием, которым пользовался Дьюар, изображен схематически на фиг. 4.Фиг. 4. Прибор Дьюара для сжижения воздуха.Эта схема расположения приборов была сообщена Дьюаром еще в 1895 году. А изображает один из резервуаров со сжатым водородом, В и С — сосуды с пустотой между стенками, содержащие первый углекислоту, кипящую под уменьшенным давлением, второй жидкий воздух. D представляет собою змеевик, G капиллярное отверстие и F клапан, регулирующий истечение водорода. При непрерывном истечении водорода в подобном приборе Дьюар легко получил твердый воздух (—214°), но водород при этом не обнаружил признаков С. Окончательные опыты произведены 10 мая 1898 г. с водородом, охлажденным до —205° С и сжатым предварительно до 180 атм. После непрерывного истечения водорода в этих условиях, при расходе 10—15 куб. фут в минуту, в сосуде особого устройства с пустотой внутри и высеребренными стенками и при охлаждении еще снаружи до —200° С. водород стал капать из описанного прибора в другой, меньших размеров, дважды изолированный при помощи пустоты; через 5 минут действия было получено 20 куб. стм жидкого водорода, но дальнейшее получение должно было прекратиться вследствие образования пробки из твердого воздуха, который в виде примеси заключался в водороде. Оказалось, что в жидком виде получается до 1% всего водорода. Жидкий водород бесцветен и прозрачен; не дает линий поглощения, имеет, по-видимому, большой показатель преломления и образует в сосуде ясно выраженный мениск. Плотность жидкого водорода оказывается около 0,07, что составляет почти половину предсказанной теоретической плотности по атомным объемам и предельной плотности, найденной Амага по изотермам водорода. В том, что при этом опыте температура была очень низка, Дьюар убедился, погружая в жидкий водород запаянную только снизу трубку; эта трубка быстро наполнилась твердым воздухом. Другой опыт был произведен с гелием, запаянным в баллоне, имевшем маленький отросток; при погружении этого отростка в жидкий водород можно было видеть появившийся мениск; этим было доказано, что нет очень большой разницы в точках кипения водорода и гелия. При дальнейших работах Дьюар старался определить температуру кипения водорода, но встретил большие затруднения; температуры, полученные по различным методам, дали различные результаты; так, при 25 мм давления он нашел температуру кипения —238° С, или +35° от абсолютн. нуля, по изменению сопротивления чистой платины гальваническому току, —246° С, или 27° абсол., по сопротивлению проволоки из сплава платины и родия, —252 С., или 21° от абсол. нуля, по водородному термометру (см. Термометр, измерения низких температур). В последнее время Дьюар получил водород в твердом виде, достигнув 15° от абсолютного нуля. Твердый водород по виду сходен с твердым воздухом и не обнаружил видимых свойств металла. В настоящее время обращены в жидкость все газы и исследуются свойства разных веществ при очень низких температурах. Следующие сжиженные газы представляют интерес: озон сж. Готфейдем и Шаппюи (1882), его темп. кипения —119°. Фтор обращен в жидкость Муассаном и Дьюаром в 1897 г., его температура кипения —187°. Фтор при очень низких температурах не действует на стекло, но еще сохраняет сродство по отношению к водороду. Аргон сжижен и обращен Ольшевским в 1897 г. в твердое тело (—189,6° С). Многие свойства тел, как физические, так и химические, весьма интересны и иногда сильно изменяются при очень низких температурах; так, сопротивление проводников непрерывно убывает, стремясь к нулю при абсолют. нуле; наоборот, электролиты теряют способность проводить ток. Диэлектрические постоянные убывают весьма быстро с понижением температуры, напр., диэлектрическая постоянная глицерина от 60 уменьшается до 2,43. Явления фосфоресценции, незаметные, напр., у парафина при обыкновенной темп., при низких — крайне энергичны; многие тела, наоборот, теряют свойство фосфоресцировать. Явления упругости сильно изменяются: каучук становится крайне хрупким, но железо обнаруживает большую упругость. Низкие температуры и С. дают отличное средство разделять газы фракционированием — есть даже заводской способ получения кислорода путем отгонки азота. Наконец, найдены новые газы Рамзаем: неон, криптон и метаргон. Литература по С. газов рассеяна по научным и даже популярным изданиям. Наиболее доступное и наглядное изложение, также полная литература приведена в "La liquéfaction des gaz et ses applications" ("Encyclopédie scientifique des aidemémoire" par. J. Lefévre); Sloan, "Liquid Air".Н. Смирнов. Δ.
Фиг. 1. Прибор Дьюара для сжижения кислорода и воздуха.В этом приборе кислород охлаждается предварительно до —79° при помощи углекислоты, которая, входя по трубке (из резервуара с жидкой углекислотой, не изображенного на фиг.) через а, проходит в змеевик, изображенный в сечении черными кружками, доходит до клапана R, здесь расширяется, охлаждая все внутреннее помещение, затем проходит между стенками прибора и выходит через отверстие в наружной стенке е. Кислород, сжатый до 100—150 атмосфер в стальном резервуаре, входит по трубке (не изображена) через b в змеевик, изображенный в сечении белыми кружками, охлаждается кипящей углекислотой, проходя по змеевику, проходит между средними стенками к расширительному точному клапану с, здесь, расширяясь, охлаждается и (после некоторого времени действия) обращается в жидкость, стекая на дно сосуда d. Из сосуда d кислород (или после С. пары) проходит мимо змеевика навстречу непрерывно поступающему к клапану с свежему кислороду, охлаждает его перед самым расширением и, наконец, проходит далее, между наружными стенками и выходит наружу вместе с углекислотой через е. Нетрудно видеть, что понижение температуры, получающееся при расширении кислорода в клапане с, способствует усиленному охлаждению поступающего вновь кислорода, что вызывает (см. формулу) новое понижение температуры при расширении, и так продолжается до тех пор, пока температура не упадет до температуры кипения кислорода. Весьма существенную часть аппарата представляет сосуд d. Это стеклянный стакан с двойными стенками и с Круксовой (см.) пустотой внутри стенок. Благодаря отсутствию теплопроводности и конвекции он раз в 20 лучше изолирует, чем сосуд без пустоты. Еще более сильная изоляция достигается, если высеребрить стенки внутри стенок, чем уменьшается роль лучеиспускания (Дьюар). Подобный же прибор служит Дьюару и для С. воздуха, но с тою разницей, что испарение углекислоты, служащей для предварительного охлаждения воздуха, происходит под малым давлением 25 мм ртутного столба, когда температура кипения углекислоты = —115° С. Прибор Линдо для С. воздуха представляет значительное преимущество перед прибором Дьюара в том смысле, что не требует предварительного охлаждения, хотя с точки зрения затраты механической работы едва ли может считаться экономичнее. Фиг. 2, схематическая, наглядно объясняет принцип устройства машины Линде.Фиг. 2. Прибор Линде для сжижения воздуха.Воздух накачивается насосом С, где сжимается до давления р1; проходя в холодильник R, этот воздух, сильно разогретый вследствие сжимания в насосе, охлаждается текущей водой до температуры t1 и затем проходит во внутренний змеевик к регулирующему клапану r. Проходя через очень малое отверстие в этом клапане, воздух расширяется от давления p1 до р2 и при этом охлаждается наθ°= 0,276(p1—p2)(273/T)2и затем идет навстречу вновь поступающему из насоса воздуху, проходя по кольцевому пространству наружного змеевика и наконец завершает свой круговорот, вновь поступая в насос. Оба змеевика, внутренний и внешний, свернуты из медных трубок вместе и при этом хорошо изолированы друг от друга; вся система от внешнего притока тепла хорошо изолируется неочищенной шерстью. Когда прибор в действии, воздух охлаждается от t1 до t2 во внутреннем змеевике, затем еще охлаждается вследствие расширения в клапане r от t2 до t3; проходя наружным змеевиком, он охлаждает идущий навстречу воздух, нагреваясь при этом до t4 и вновь поступает в насос. При таком круговороте происходит прогрессивное охлаждение воздуха до его С.; жидкий воздух стекает на дно сосуда G, откуда может быть вылит наружу. Второй насос, помещенный в A, доставляет новое количество воздуха взамен сжиженного. Есть выгода не давать во время действия прибора полного расширения воздуха до атмосф. давления, так как работа, потребная для сжатия воздуха в насосе, пропорциональна log отношения давлений p1/p2 (при изотермическом сжатии, см. Теплота); поэтому желательно по возможности уменьшить это отношение. Так как для надлежащего охлаждения в приборе Линде приходится иметь p1 = около 200 атмосфер, то, давая расширение до атмосферы, имеем это отношение = 200, а дав, например, расширение до 15 атмосфер, мы получим отношение около 13. Взяв логарифмы, мы увидим, что во втором случае потребуется меньше работы почти вдвое. Между тем охлаждение на основании явления Джоуля-Томсона зависит лишь от разности (р1—р2), которая при наших предположениях будет: в первом случае 199, а во втором 185, что не особенно ухудшит действие прибора. Подобное же отношение работ получится и при адиабатическом сжатии, но сама работа в этом случае будет гораздо более, чем при изотермическом сжатии при температуре t; последнее для быстроходного насоса осуществить крайне трудно. Фиг. 3 изображает одну из более поздних моделей и предназначена для лаборатории.Фиг. 3. Прибор Линде для сжижения воздуха.Прибор состоит из насоса с двумя цилиндрами и охлаждающего аппарата, состоящего из трех концентрических змеевиков. Воздух входит прямо из комнаты в насос, все время охлаждаемый текущей водой (кроме того, некоторое количество воды всасывается внутрь в цилиндры) для того, чтобы противодействовать по возможности повышению температуры при сжатии, а также для уменьшения вредных пространств в цилиндрах и пр. В первом цилиндре воздух сжимается до р1 = 16 атмосфер, во втором — от 16 до 200. Сжатый воздух проходит в сепаратор f, где происходит отстаивание воды, которая время от времени удаляется при помощи крана, находящегося внизу f. Из f далее воздух идет в ящик g, где несколько охлаждается смесью снега и соли; при этом пары воды замерзают, и воздух таким образом значительно осушается, что весьма важно, иначе прибор поминутно забивался бы льдом. Затем воздух проходит по внутреннему змеевику внутрь холодильного аппарата; посредством клапана а дают расширение от 200 атм. до 16, охлажденный при этом воздух (клапан b закрыт) по среднему змеевику возвращается назад ко второму цилиндру насоса, снова сжимается до 200 атм. и вновь проходит тот же путь. Некоторое количество воздуха, охлажденного расширением в а, при помощи второго клапана b можно подвергнуть еще расширению от 16 до одной атмосферы; часть этого воздуха (около 5%) при установившемся режиме сжижается, собираясь в сосуде с, остальной воздух, пройдя еще по третьему змеевику (см. фиг.), выходит наружу. Жидкий воздух, собирающийся в сосуде с (описанном при приборе Дьюара), при помощи стеклянной трубки, доходящей до дна сосуда и крана h, может быть выпущен в стеклянные же колбы, имеющие также пустоту внутри двойных стенок. Подобные приборы Линде производят около 1 литра жидкого воздуха в час; при затрате 3 лошадиных сил С. может начаться после 1/2 — 1 часа работы. Машины Триплера и Гампсона также появились около 1895 г. Машина Триплера значительно сложнее машины Линде, она может давать 9—13 литров жидкого воздуха в час. В машине Гампсона воздух сжимается всего до 120 атм. и расширяется прямо до атмосферного давления, расширительный клапан дает отверстие в виде щели, жидкий воздух получается через 16 минут действия и через 1 минуту, если прибор предварительно охлажден при помощи жидкой углекислоты. Получение жидкого воздуха в больших количествах, низкая темп. его кипения при атмосферном давлении (около —180° — —190°С) весьма упростила манипуляции для применения очень низких температур (до —200° С при разрежении). После столь большого успеха оставалось лишь обратить в жидкость водород. Первая серьезная попытка получить водород в виде жидкости была сделана Врублевским в январе 1884 года. Водород, сжатый в капиллярной трубке до 100 атм. и охлажденный до температуры кипения кислорода (—200°С) при мгновенном уменьшении давления до 1 атм. обнаружил явление вроде вскипания, полученное Кальете при опыте с кислородом. Врублевский счел нужным сообщить об этом, когда Ольшевский сообщил о получении им водорода в виде бесцветной жидкости при расширении от 190 атм. и охлаждении жидким кислородом. Но опыты, повторенные Врублевским, не подтвердили этого явления; наоборот, выяснилось, что при подобном методе ввиду крайне непостоянной температуры нельзя с уверенностью говорить о получении жидкости. При самой низкой температуре, которую можно было смерить (около —223° С), водород заведомо не обращался в жидкость. После неудачи получить более низкие температуры Врублевский занялся изучением изотерм (см. Газы сжиженные) водорода, и, имея их, он вычислил коэффициент формулы Ван дер Ваальса и дал такие критические постоянные водорода:----------------------------------------------------------------------------------------------------------------------| По данным: | Врублевского | Ольшевского из опыта 1895 г. ||---------------------------------------------------------------------------------------------------------------------|| Критическая температура | —240° С | —234° С ||---------------------------------------------------------------------------------------------------------------------|| Критическое давление | 13 атм. | 20 атм. ||---------------------------------------------------------------------------------------------------------------------|| Температура кипения | —250° С | —243° С |----------------------------------------------------------------------------------------------------------------------Дальнейшие исследования Ольшевского и Дьюара подтвердили правильность заключений Врублевского и обнаружили очень большую неточность в определении критического давления водорода, получаемого по формуле Сарро, основанной на опытах Амага над сжатием водорода; критическое давление, полученное отсюда, 99 атм., оказалось раза в 4 больше полученного впоследствии (см. Газы в критическом состоянии). Затем работы по С. водорода настойчиво продолжались Ольшевским и Дьюаром независимо друг от друга, но окончательно вопрос был решен Дьюаром в мае 1898 года. Прием, которым пользовался Дьюар, изображен схематически на фиг. 4.Фиг. 4. Прибор Дьюара для сжижения воздуха.Эта схема расположения приборов была сообщена Дьюаром еще в 1895 году. А изображает один из резервуаров со сжатым водородом, В и С — сосуды с пустотой между стенками, содержащие первый углекислоту, кипящую под уменьшенным давлением, второй жидкий воздух. D представляет собою змеевик, G капиллярное отверстие и F клапан, регулирующий истечение водорода. При непрерывном истечении водорода в подобном приборе Дьюар легко получил твердый воздух (—214°), но водород при этом не обнаружил признаков С. Окончательные опыты произведены 10 мая 1898 г. с водородом, охлажденным до —205° С и сжатым предварительно до 180 атм. После непрерывного истечения водорода в этих условиях, при расходе 10—15 куб. фут в минуту, в сосуде особого устройства с пустотой внутри и высеребренными стенками и при охлаждении еще снаружи до —200° С. водород стал капать из описанного прибора в другой, меньших размеров, дважды изолированный при помощи пустоты; через 5 минут действия было получено 20 куб. стм жидкого водорода, но дальнейшее получение должно было прекратиться вследствие образования пробки из твердого воздуха, который в виде примеси заключался в водороде. Оказалось, что в жидком виде получается до 1% всего водорода. Жидкий водород бесцветен и прозрачен; не дает линий поглощения, имеет, по-видимому, большой показатель преломления и образует в сосуде ясно выраженный мениск. Плотность жидкого водорода оказывается около 0,07, что составляет почти половину предсказанной теоретической плотности по атомным объемам и предельной плотности, найденной Амага по изотермам водорода. В том, что при этом опыте температура была очень низка, Дьюар убедился, погружая в жидкий водород запаянную только снизу трубку; эта трубка быстро наполнилась твердым воздухом. Другой опыт был произведен с гелием, запаянным в баллоне, имевшем маленький отросток; при погружении этого отростка в жидкий водород можно было видеть появившийся мениск; этим было доказано, что нет очень большой разницы в точках кипения водорода и гелия. При дальнейших работах Дьюар старался определить температуру кипения водорода, но встретил большие затруднения; температуры, полученные по различным методам, дали различные результаты; так, при 25 мм давления он нашел температуру кипения —238° С, или +35° от абсолютн. нуля, по изменению сопротивления чистой платины гальваническому току, —246° С, или 27° абсол., по сопротивлению проволоки из сплава платины и родия, —252 С., или 21° от абсол. нуля, по водородному термометру (см. Термометр, измерения низких температур). В последнее время Дьюар получил водород в твердом виде, достигнув 15° от абсолютного нуля. Твердый водород по виду сходен с твердым воздухом и не обнаружил видимых свойств металла. В настоящее время обращены в жидкость все газы и исследуются свойства разных веществ при очень низких температурах. Следующие сжиженные газы представляют интерес: озон сж. Готфейдем и Шаппюи (1882), его темп. кипения —119°. Фтор обращен в жидкость Муассаном и Дьюаром в 1897 г., его температура кипения —187°. Фтор при очень низких температурах не действует на стекло, но еще сохраняет сродство по отношению к водороду. Аргон сжижен и обращен Ольшевским в 1897 г. в твердое тело (—189,6° С). Многие свойства тел, как физические, так и химические, весьма интересны и иногда сильно изменяются при очень низких температурах; так, сопротивление проводников непрерывно убывает, стремясь к нулю при абсолют. нуле; наоборот, электролиты теряют способность проводить ток. Диэлектрические постоянные убывают весьма быстро с понижением температуры, напр., диэлектрическая постоянная глицерина от 60 уменьшается до 2,43. Явления фосфоресценции, незаметные, напр., у парафина при обыкновенной темп., при низких — крайне энергичны; многие тела, наоборот, теряют свойство фосфоресцировать. Явления упругости сильно изменяются: каучук становится крайне хрупким, но железо обнаруживает большую упругость. Низкие температуры и С. дают отличное средство разделять газы фракционированием — есть даже заводской способ получения кислорода путем отгонки азота. Наконец, найдены новые газы Рамзаем: неон, криптон и метаргон. Литература по С. газов рассеяна по научным и даже популярным изданиям. Наиболее доступное и наглядное изложение, также полная литература приведена в "La liquéfaction des gaz et ses applications" ("Encyclopédie scientifique des aidemémoire" par. J. Lefévre); Sloan, "Liquid Air".Н. Смирнов. Δ.
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — С.-Пб.: Брокгауз-Ефрон. 1890—1907.