- Нитроглицерин
-
I
Глицерин C3H5(НО)3, при действии азотной кислоты или смеси азотной и серной кислот, может образовать азотно-кислые эфиры: С3H5(HO)2(NO3), С3H5(HO)(NO3)2 и С3H5(NO3)3.Из них в настоящее время известны только два — одноазотный и трехазотный. Первый, получаемый при смешении глицерина с умеренно разведенной азотной кислотой (1ч. HNO3 на 3 ч. Н2O) представляет жидкость, легко растворимую в воде и спирте, почти не растворимую в эфире и не взрывающуюся от удара. Трехазотный эфир получается при действии на глицерин смеси наиболее крепких кислот азотной и серной и отличается от предыдущего по своему отношению к растворителям, и в особенности по чрезвычайно сильной взрывчатости при быстром нагревании и ударе. Этот последний эфир и есть то могущественное взрывчатое вещество, которое впервые было приготовлено Собреро в лаборатории Пелуза в 1847 г. и с тех пор во взрывчатой технике называется Н. В числе первых лиц, давших толчок к применению его в практике, следует назвать профессора Зинина (1854 г.) и поручика артиллерии (впоследствии ген.-лейтенанта) В. Ф. Петрушевского, но главная заслуга в этом отношении бесспорно принадлежит шведскому инж. Альфреду Нобелю, который изобрел способ (превращением в динамиты) делать его достаточно безопасным при перевозке и обращении. В настоящее время производство Н. представляет одну из видных отраслей обрабатывающей промышленности.1) Для приготовления нитроглицерина применяется общая реакция получения азотно-кислых эфиров алкогольных веществ, т. е. действие на глицерин (1 часть) крепкой азотной кислотой (3 части) в присутствии концентрированной серной кислоты (6 частей):С3H5(HO)3 + 3HNO3 = С3H5(NO3)3 + 3H2O.Присутствие серной кислоты необходимо при этом, с одной стороны, для поглощения выделяющейся при реакции воды, которая, в противном случае, разжижая азотную кислоту, тем самым препятствовала бы полноте нитрации (стали бы получаться неполные азотные эфиры глицерина), с другой — для выделения образующегося Н. из раствора в азотной кислоте, так как он, будучи хорошо растворим в этой кислоте, не растворяется в смеси ее с серной. Эта реакция образования Н. сопровождается значительным самонагреванием, потому что, как самая этерификация глицерина азотной кислотой, так и соединение образующейся воды с серной кислотой отделяют тепло. Если бы вследствие самонагревания температура смеси повысилась до 50°, то действие кислот легко направилось бы в другую сторону: началось бы окисление глицерина и Н., сопровождающееся бурным выделением окислов азота (красно-бурых паров) и еще большим самонагреванием, которое могло бы окончательно привести к взрыву образовавшегося нитроглицерина. Поэтому реакцию должно вести при постоянном охлаждении смеси кислот и глицерин прибавлять к последней понемногу, размешивая каждую прилитую порцию. Образующийся непосредственно при соприкосновении с кислотами Н., обладая меньшим уд. весом (1,6) сравнительно с кислотной смесью (не менее 1,7), всплывает на поверхность, откуда и может быть собран по окончании реакции. Но самонагреванию при приготовлении Н. можно противодействовать и другим способом, именно — заставляя часть тепла выделиться ранее самого образования Н. и в особенности — замедляя реакцию этого образования предварительным изменением химического состояния реагирующих веществ. Бутми и Фоше достигли этого, приготовляя предварительно две отдельные смеси — серно-глицериновую и серно-азотную. Последняя составляется из равных частей Н2SO4 н HNO3, а первая из одной части С3H5(НО)3 с тройным количеством H2SO4, при чем образуется серно-глицериновый эфир C3H5(HO)2HSO4 со значительным отделением тепла. Если обе смеси, после охлаждения, смешать между собой в такой пропорции, чтобы отношение количеств C3H5(НО)3, Н2SO4 и HNO3 было приблизительно такое же, как в предыдущем способе, то: а) превращение серно-глицеринового эфира в Н. идет постепенно и медленно, так что оканчивается только через 12 и даже 24 часа, б) количество отделяемого тепла в течение всего этого процесса значительно понижается, так как та часть теплоты, которая происходит вследствие соединения воды с серной кислотой, уже выделилась ранее при образовании серно-глицериновой смеси, и с другой стороны, сам глицерин, превратившись в серно-глицериновый эфир, потерял тогда же часть своей энергии в виде тепла. Вследствие обеих приведенных причин приготовление Н. по этому способу и не может сопровождаться значительным разогреванием, так как пониженное количество теплоты при замедленном течении реакции успевает передаваться окружающей среде. Причина, почему система трех тел С3H5(НО)3, H2SO4 и HNO3, независимо от начального состояния, превращается так, что глицерин предпочтительно соединяется с азотной кислотой, а серная кислота — с выделяющейся водой, по толковании Бертело, заключается в том, что именно такая окончательная система тел отвечает наибольшему отделению тепла, т. е. принимаемому этим ученым принципу максимума работы, как общему правилу хода химических реакций. В действительности же вопрос сложнее, ибо и в реакции образования Н., как и в громадном большинстве других реакций, наблюдается обычное действие общего закона химических масс. В самом деле, опыты показывают, что из данного количества глицерина, при обыкновенных условиях приготовления, никогда не получается теоретического выхода трехазотного его эфира, а именно: из 100 ч. С3H5(НО)3 не более 234, а обыкновенно около 210 ч. вместо 247. Это объясняется тем, что, по мере прибавления данного количества глицерина, в кислотной смеси остается все меньше и меньше HNO3, между тем как масса H2SO4 остается одной и той же, пока не наступает, наконец, такое отношение между количествами той и другой кислоты, при котором, в присутствии выделенной ранее воды, глицерин превращается в неполные азотные эфиры или даже совсем перестает нитроваться, образуя только серно-кислый эфир.Заводское приготовление Н. может производиться по обоим указанным способам. Но способ Бутми и Фоше, примененный вскоре после его появления на нескольких заводах (франц. — в Вонже; бельг. — в Намюре, англ. — в Памберее), ныне совсем оставлен, как менее выгодный (выход продукта только 190 ч. из 100 ч. глицерина) и притом (судя по несчаст. случаям на этих заводах) не более безопасный сравнительно с обыкновенным способом, тем более, что при таком продолжительном соприкосновении Н. с кислотами (12 — 24 час.), какое имеет место при нитровании по этому способу, все-таки не предотвращается возможность развития реакции окисления с бурным выделением окислов азота. Что же касается обыкновенного способа, то, будучи вообще более выгодным в экономическом отношении, он, в то же время, теперь считается и более безопасным при надлежащей чистоте исходных материалов. Форма, в какой он применяется на заводах, может быть очень различна в своих подробностях. Сначала приготовляли Н. обыкновенно малыми порциями подобно тому, как это делается в лабораториях. Так, по Коппу, к 2800 г кислотной смеси в глиняном или чугунном горшке, помещенном в сосуд с водой (5 — 6 литров), приливают 350 г глицерина из кружки при постоянном размешивании стеклянной или железной палочкой; получившуюся смесь переливают в разделительную воронку и выпускают отстоявшиеся кислоты, а Н. выливают в вышеозначенный сосуд с водой для промывания. Позднее стали, с одной стороны, увеличивать порции обрабатываемого за один раз глицерина, с другой — применять для размешивания при нитровании различные механические приспособления. Важным усовершенствованием в последнем отношении явилось применение (в первый раз на фабрики Мовбрея в Массачусетсе) продувания смеси сжатым воздухом, который производит не только перебалтывание, но и охлаждение вследствие своего расширения: в глиняные горшки, помещенные в общей водяной ванне кругом вытяжной трубы, наливается по 7 — 8 кг кислотной смеси обыкновенного состава, см. выше), и к этой смеси приливается по 0,8 кг глицерина с помощью сифонов из бутылей, поставленных на полке; при этом в каждый горшок по особой трубки проводится струя сжатого воздуха. С 1880 г. начали переходить к способам, в которых подвергаются обработке зараз большие количества глицерина, как это делается на заводах Нобеля, что опишем подробнее.Исходные материалы, т. е. кислоты азотная, серная и глицерин, должны быть возможно чистые и безводные, именно: серная кислота уд. в. 1,84 с содержанием не менее 95 — 96% H2SO4, азотная — уд. веса 1,50 с содержанием не мене 93% HNO3 и глицерин уд. в. 1,26 с содержанием не более 3% воды. Такие примеси, как значительные количества азотноватой окиси в азотной кислоте или присутствие жирных кислот в глицерине, особенно вредны, так как они способствуют возбуждению опасных реакций окисления и препятствуют чистоте промывки приготовляемого Н. Приготовление кислотной смеси производится в больших цилиндрических чугунных сосудах с мешалками внутри или без мешалок. В последнем случае сначала вливается все отвешенное количество азотной кислоты, серная же кислота в соответственном количестве прибавляется после, причем вследствие разницы уд. весов обеих кислот местных разогреваний, однородность смешения достигается сама собой. Пропорция смешения, применяемая в настоящее время — на 1 ч. азотной кислоты ок. 1,666 ч. (большей частью) или 2 ч. (реже) серной кислоты. Из сосудов для смешивания смесь переводится в нитрационные аппараты или самотеком, или же с помощью толстостенных чугунных пневматических подъемников (montejus). Относительные количества при нитровании — на 1 ч. глицерина от 8 до 8,5 ч. кислотной смеси. Это количество смеси — значительно больше требуемого теорией, так как в 8 — 8,5 частях ее содержится около 3 ч. HNO3, между тем как по теории для превращения 1 ч. глицерина в Н. требуется этой кислоты только 2,05 частей. При большом производстве азотная кислота обыкновенно приготовляется на том же заводе из чилийской селитры с помощью отработанной кислотной смеси. Самое нитрование глицерина производится в нитрационном аппарате (фиг. 1).
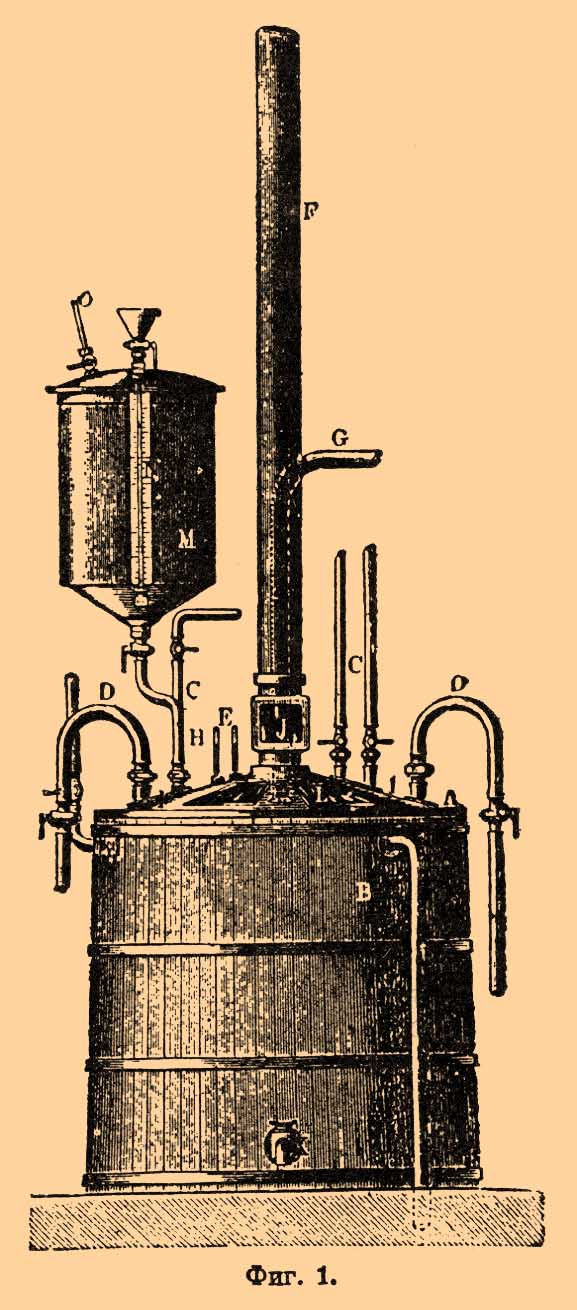 Фиг. 1.Он состоит из свинцового сосуда А, помещенного в деревянном чане В и закрывающегося съемной свинцовой крышкою I, которая при работе замазывается цементом. Через крышку проходят: концы двух свинцовых змеевиков D, находящихся внутри аппарата и назначаемых для охлаждения смеси посредством протекающей через них холодной воды; трубки С, приводящей в аппарат сжатый холодный воздух для размешивания при работе; труба F, отводящая из аппарата пары азотной кислоты; термометры Е, из которых один доходит почти до дна, а другой погружен только в верхний слой жидкости; трубка G для наливания отмеренного количества кислотной смеси; трубка Н для приливания глицерина, согнутая у дна аппарата в кольцо, с мелкими отверстиями. Кроме того, в крышке несколько стеклянных оконцев L для наблюдения за явлениями, происходящими в аппарате. Подобное же оконце J устроено и в вытяжной трубе для наблюдения бурых паров окислов азота, образующихся в случаях развития в аппарате опасных реакций окисления или так наз. разложения Н. Сосуд M служит для отмеривания количества глицерина, определяемого по указательной трубке N, а также для впрыскивания его в кислотную смесь посредством сжатого (до 2 атмосф.) воздуха, впускаемого по трубки О. Через кран К жидкость выпускается из аппарата. Холодная вода при работе проводится не только через внутренний змеевик, но и через кольцеобразное пространство между свинцовыми и деревянными наружными станками. За один раз обрабатывают 150 кг глицерина. Впустив требуемое количество кислотной смеси и охладив ее (пропусканием холодного сжатого воздуха и током воды) до 15 — 20°, начинают вбрызгивание глицерина (с температурой не ниже 20°), регулируя приток его таким образом, чтобы нагревание в аппарате не поднималось выше 25 — 30°. Если температура продолжает повышаться, приближаясь к означенному пределу даже по прекращении притока глицерина, то усиливают пропускание холодного воздуха, а если и после того поднятие не останавливается, то содержимое аппарата быстро выпускается в большой чан с водой; в противном случае легко может начаться разложение H., могущее окончиться взрывом. Вся операция обработки глицерина кислотами, считая наполнение смесью и опоражнивание, требует не более 1 — 11/2 часа времени. Отделение Н. от кислот производится отстаиванием их смеси в так наз. сепараторе (фиг. 2).Фиг. 2.Это — свинцовый четырехугольный ящик с коническим дном, вставленный в такой же деревянный ящик А. В крышке находятся: вытяжная труба D с оконцем Е; трубка К для введения смеси из нитрационного аппарата; отверстие для вставления термометра и несколько оконцев. Такое же оконце J с плотно заделанным стеклом находится и на боковой стенке для наблюдения уровней кислоты и всплывающего Н. От конического дна сосуда идет трубка G с оконцем F и кранами Н. Всплывание Н. на поверхность кислот происходит легче, если по мере выделения спускать его через кран J в рядом стоящий промывочный чан L. Присутствие посторонних примесей, напр. жиров в глицерине, серно-кислого свинца и т. п., затрудняет выделение. При нормальных условиях, с чистыми материалами, операция продолжается около 30 мин. По окончании сливания почти всей массы Н. выпускают кислотную смесь через один из нижних кранов, пока в оконце F не появятся слой мутной смеси, состоящей из примесей и различных низших нитропродуктов. В этот момент закрывают кран и выпускают остаток смеси в подходящий сосуд для переноса в чан L. Низшие нитропродукты, образующиеся из самого глицерина или посторонних примесей, обладают меньшим уд. весом сравнительно с Н., всплывают на нем в виде пены и являются особенно склонными к разложению со значительным отделением тепла при действии воздуха. Это нужно иметь в виду при производстве отделения Н., так как присутствие означенной пены может вызвать разложение и внутри сепаратора; тогда в оконце Е появляются красно-бурые пары и температура начинает сама собой подниматься. В таких случаях содержимое выпускается через третий нижний кран в большой чан с водой, как при разложениях в нитрационном аппарате.Промывание Н., отделенного от избытка кислот, производится в два приема. Сначала подвергают его предварительной промывке в вышеупомянутом чане L. Это — цилиндрический свинцовый сосуд с наклонным дном и двумя кранами М, из которых нижний назначен для выпуска Н., а верхний для выливания воды. Перебалтывание производится помощью сжатого (до 2 атмосф.) воздуха, впускаемого по трубе N, которая внизу загнута и снабжена рядом мелких отверстий. Отстаивание, вследствие большой разницы уд. весов воды и Н., происходит быстро. Начальная температура воды должна быть ок. 15°, а во время приливания Н. не должна подниматься выше 30°. После первой промывки таким же образом производят вторую и третью; в последний раз промывают еще в 2,5% растворе соды, наливая этот раствор слоем в несколько сантиметров толщиной. Для окончательного удаления кислоты, Н. спускается в деревянные чаны, выложенные внутри свинцом и по своему устройству подобные предыдущему чану. Употребляя тройной объем воды, здесь производят от 10 до 18 промывок по 15 мин. каждую с перебалтыванием смеси с помощью сжатого воздуха (или механических мешалок); при 3-й и 5-й промывках вместо воды берется 1% раствор соды. Наиболее благоприятная температура воды 25 — 33°; на некоторых заводах первая промывка ведется при 50°. Продукт считается хорошо промытым, если он выдерживает нижеописанное испытание на стойкость при нагревании. Последняя операция при фабрикации состоит в фильтровании Н. для обезвоживания и удаления случайных твердых примесей. С этою целью его пропускают через специальные фильтры (фиг. 3).Фиг. 3.В крышку деревянного, выложенного внутри свинцом, цилиндрического сосуда А с наклоненным дном вставлен фильтрационный свинцовый цилиндр G; на нижнем крае его К лежит бронзовое кольцо L с сеткой M и войлоком; на них насыпается слой прокаленной поваренной соли О и сверху кладется еще войлок P со свинцовым кольцом Q; на верхний войлок надавливает груз R. С помощью ручек J фильтрационный цилиндр может легко выниматься для чистки его или осмотра внутренности сосуда. Такой фильтр, смоченный безводным H., не пропускает сквозь себя механически примешанную (эмульсированную) воду, последние же следы влаги (растворенной в Н.) поглощаются поваренной солью; с целью лучшего высушивания — к последней иногда прибавляют высушенный хлористый магний. В кислотной жидкости, отделенной от продукта, с течением времени может образоваться еще небольшое количество Н.; поэтому эта жидкость, прежде чем пустить ее на переработку для извлечения HNO3 и Н2SO4, подвергается предварительному отстаиванию (около недели) в больших сепараторах, устроенных подобно вышеописанному; всплывающий Н. время от времени сливается и подвергается обычному промыванию. С другой стороны, спускаемые промывные воды также уносят c собой некоторое количество продукта механически; для отделения и улавливания мелко раздробленного в этих водах Н., их пропускают через длинный свинцовый ящик с поперечными перегородками, снабженными вырезами попеременно, то внизу, то вверху (фиг. 4).Фиг. 4.Относительно извлекаемого при этих обеих операциях Н. нужно заметить, что он требует особенно тщательной промывки, так как в нем именно накопляются вышеупомянутые вредные низшие нитропродукты.2) Чистый Н., приготовленный из совершенно бесцветного глицерина с помощью чистых кислот, представляет маслянистую, бесцветную, как вода, жидкость, без запаха при обыкновенной температуре, со сладковатым, несколько жгучими вкусом; но полная, бесцветность редко получается, и обыкновенные его образчики бывают желтоватого или буроватого цвета. Очень ядовит; отравление может происходить не только при принятии внутрь и вдыхании паров, но и через кожу при простом прикосновении, и проявляется обыкновенно сильными головокружениями, головными болями, рвотой и т. п.; смертные случаи возможны при принятии внутрь значительных количеств (до 10 г). При легком отравлении страдания облегчаются посредством крепкого черного кофе и уксусно-кислого морфия (в очень малых дозах), но к такому отравлению рабочие на заводах привыкают и без видимого влияния на здоровье вскоре перестают ощущать болезненные припадки. На холоде Н. застывает в белую кристаллическую массу. Температура его плавления возрастает по мере увеличения чистоты: продукт обыкновенной очистки плавится при + 9° или + 10°, а перекристаллизованный несколько раз — при + 13,3°. Уд. вес в жидком состоянии 1,599, в твердом 1,735. Вода растворяет Н. в чрезвычайно малом количестве (около 0,003%), но он растворим во многих органических растворителях, напр. в спиртах метильном, этильном и амильном, ацетоне, в обыкновенном и уксусном эфире, уксусной кислоте, хлороформе, бензоле и т. п. Из очень крепких растворов в метиловом спирте, при охлаждении, можно кристаллизовать Н. и тем самым достигать наибольшего его очищения; кристаллизация происходит особенно легко, если в охлажденный до 0° раствор бросить готовый кристаллик его. Сам Н. растворяет в себе камфару, растворимый пироксилин (коллодий) и другие подобные вещества. В виде растворов в метиловом спирте Нобель, до открытия динамитов, предлагал перевозить и хранить Н., так как в таком состоянии он не чувствителен к случайным ударам, но прибавлением воды тотчас выделяется в осадок со всеми своими свойствами. Упругость паров Н. в пустоте: при 15° — 5 мм, при 87° — 27 мм, при 100° — 30 мм. Двухчасовая промывка в воде, нагретой до 50°, при пропускании сжатого воздуха, производит потерю 0,15% через испарение. Эти потери могут быть значительны, если в нагреваемых препаратах Н. находится в мелко раздробленном состоянии, напр. динамит, нагреваемый при 40° — 50° в. течение нескольких дней, иногда теряет до 10%. Хорошо промытый и высушенный Н. есть вещество постоянное, в течение неопределенно долгого времени — при температурах до 50°, а на более короткие промежутки времени — и при температурах до 100°. Но если он недостаточно чист (содержит кислоты), то может медленно разлагаться и при обыкновенной температуре: появляются бурые пары окислов азота, жидкость окрашивается в зеленоватый цвет и получает сильно кислую реакцию, образуются щавелевая и другие органические кислоты и т. п. В состоянии такого медленного разложения Н. легко взрывается от действия сравнительно слабых импульсов, и даже сам собой — вследствие местных самонагреваний. Новым промыванием такой начавший разлагаться продукт не всегда удается возвратить к первоначальному нормальному состоянию. Поэтому полнота очистки Н. при фабрикации имеет большое значение и должна быть всякий раз испытана. С этою целью обыкновенно производят два испытания — на нейтральность и стойкость при 65°. Первое осуществляется таким образом, что около 2 куб. см продукта взбалтывают в течение некоторого времени с 10 куб. см воды и, по отделении, определяют реакцию последней в присутствии фенолфталеина. Испытание стойкости при 65° производится, помещая около 3 г продукта в стеклянную трубочку с подвешенной на пробке и смоченной до половины полоской йодокрахмальной бумаги и определяя промежуток времени от начала вставления снаряженной трубочки в ванну с температурой 65° до момента появления бурого окрашивания на границе смоченной и несмоченной части полоски; такое окрашивание, появляющееся вследствие выделения йода из йодистого калия под влиянием образующихся окислов азота, не должно получаться ранее 10 или даже 30 минут. Чем чище продукт, тем продолжительнее его сопротивление нагреванию при этом испытании [Испытание на стойкость при 65° первоначально было применено Абелем к пироксилину и с тех пор известно под именем пробы Абеля. Показания этой пробы зависят от условий, а именно: а) йодокрахмальная бумага должна быть приготовлена из чисто промытой шведской фильтровальной бумаги, напитывая последнюю смесью растворов 3 г крахмала в 250 куб. см воды и 1 г йодистого калия в 250 куб. см воды; после высушивания при обыкновенной температуре листы разрезаются на полоска 12×15 мм и сохраняются в герметических банках из темного стекла, б) пробирные трубочки, длиной 14 см и шириной 16 мм, должны плотно закрываться пробками, снабженными снизу крючочками для подвешивания йодокрахмальных бумажек; в) смачивание верхней половины бумажных полосок производится 10% раствором чистого глицерина; г) при испытаниях снаряженные трубочки настолько вдвигаются в ванну, чтобы йодокрахмальные бумажки приходились тотчас над крышкой ванны]. Но для полного суждения о чистоте Н. требуется еще испытать его в отношении состава. Последнее на практике сводится собственно к определению в нем влажности и азота. Определение влажности производится оставлением навески Н. надолго при обыкновенной темп. в пустоте над хлористым кальцием, а азот определяется обыкновенно помощью нитрометра (см.); в совершенно чистом и сухом продукте должно содержаться около 18,5% азота, т. е. такое количество, которое требуется самой формулой Н. Производя нагревание весьма малых количеств осторожно, можно перегнать Н. без разложения, напр. помещая каплю его на умеренно нагретую металлическую пластинку. Но если пластинка будет нагрета настолько, что Н. тотчас же приходит в кипение, то капля взрывается. По опытам Шампиона весьма малые количества Н. при высоких температурах вообще содержатся следующим образом: при 185° — кипение с выделением бурых паров; при 194° — медленное улетучивание; при 200° — быстрое улетучивание; при 218° — быстрое сгорание; при 241° — взрыв (трудный); 257° — сильный взрыв; при 267° — слабый взрыв; при 287° — еще более слабый взрыв с пламенем. При красном калении капля Н. принимает сфероидальное состояние и улетучивается без взрыва. По Коппу, на накаленной докрасна металлической пластинке происходит слабая вспышка. Но другие явления получаются, когда подвергнуты действию высоких температур значительные количества Н. Сначала совершается в течение более или менее короткого промежутка времени медленное разложение с выделением бурых паров и улетучиванием части самого продукта, но как только температура вследствие самонагревания или принятия теплоты от ванны повышается до 180° (приблизительно), и разлагающаяся жидкость закипает, то тотчас же наступает сильный взрыв всей взятой массы. Горящие и накаленные тела весьма трудно воспламеняют Н.: зажженная спичка в нем тухнет, накаленная платиновая проволока перестает испускать свет, и т. п. Но раз зажженный, он сгорает постепенно, пока температура остальной массы не повысится до 160°, и тогда наступает общий взрыв. Гораздо легче нитроглицерин взрывается от удара. При ударе на наковальне молотком взрывается собственно часть, подвергшаяся непосредственно удару, соседние же части разбрасываются без взрыва; величина необходимой для этого работы определена в 0,75 килограммометра. Замороженный Н. менее чувствителен к удару; в этом состоянии для взрыва ему требуется сообщить работу удара почти в 3 раза большую. Лучшим средством для взрывания Н. при его употреблении является воспламенение капсюля с гремучей ртутью (0,1 — 0,3 г для жидкого и 1 — 2 г для замороженного) в непосредственном прикосновении с зарядом. При взрыве происходит разложение согласно уравнению:2CЗH5(NO3)3 = 6CO2 + 5H2O + 3N2 + 0,5O2т. е. образуется: водяной пар, углекислота, азот и кислород. Этот кислород стараются утилизировать в динамитах (см.) с деятельным поглотителем. Отсутствие окиси углерода делает продукты взрыва совершенно безвредными, что особенно ценно при подземных взрывных работах. Об объеме образующихся газов, количестве отделяющегося тепла, скорости распространения взрыва в больших зарядах, силе и т. п. см. соотв. статью По отношению к различным химическим реагентам Н. содержится подобно другим азотным эфирам: щелочами обмыливается, кислотами разлагается с выделением азотной кислоты, восстановителями превращается обратно в глицерин с выделением окиси азота или аммиака. Для открытия самых малых количеств Н. прибавляют к испытуемой жидкости анилина и концентрированной серной кислоты: получается пурпурово-красное окрашивание, которое при разбавлении водой переходит в зеленое (Вербер).И. М. Чельцов. Δ.Н. (мед.). При вдыхании паров, равно как после смазывания языка, Н., в малых дозах, вызывает головную боль, тошноту, головокружение, ощущение жара и учащенное сердцебиение; после внутреннего употребления более значительных доз наблюдались головная боль, дрожание, мышечная слабость, доходившая до полного паралича, отдышка, в некоторых случаях смертельного отравления — резкое расстройство дыхания, синюха и глубокое угнетение нервной системы. Несмотря на эти опасные свойства, Н., употребляющийся в гомеопатии при различных нервных заболеваниях (под названием "глоноина"), сравнительно недавно предложен как средство против невралгий, в особенности против припадков грудной жабы; далее, препарат этот испробован при бронхиальной астме, в некоторых случаях мигрени, при падучей, пляске св. Витта, и при остром и хроническом воспалении почек. Н. назначают по 0,0002 — 0,001 г несколько раз в день или в каплях, от 1 до 5 капель в 1% масляном или алкогольном растворе; средство это приготовляют также в пастилках.Д. К.II (дополнение к статье)После введения Н. в технику взрывчатых веществ выяснились большие неудобства в пользовании этим веществом. При замерзании Н. в динамитах значительно повышается чувствительность их к удару; целый ряд несчастных случаев был за последнее десятилетие вызван этим свойством Н. 11-го декабря 1902 года произошел от этой причины при разгрузке взрыв 1000 кг. динамита в руднике Гнейзенау (Дортмунд), повлекший за собой гибель массы людей и построек. Повторение этих случайностей вызвало созыв в 1903 году интернационального конгресса по прикладной химии, состоявшегося в Берлине; этот конгресс (профф. Вилль, Мейсснер, Гейзе, Денкер) выяснил, что замерзание Н. представляет неустранимую опасность, тем более, что даже при, температуре + 12°Ц. Н. остается твердым. Попытки устранить замерзание Н. прибавлением нитробензона, камфоры, терпентина, азотнокислого амила не удались. А. Миколайчак предложил (1904 г.) заменить Н. ди-Н., который представляет двуазотный эфир глицерина, C3H5(OH)(ONO2)2 и до этого еще не был получен. Способ получения ди-Н по патенту (1904) таков. К 10 ч. глицерина прибавляют 33 ч. азотной кислоты уд. в. 1,5 при непрерывном помешивании и охлаждении. Смесь поддерживают при темп. 10° Ц., разбавляют 10 частями воды и нейтрализуют СаСО3. При стоянии большая часть ди-Н. всплывает на поверхность и может быть механически отделена; растворенная часть может быть извлечена эфиром. Ди-Н. представляет бесцветное прозрачное масло, растворимое в воде и три-Н.; растворяет и желатинирует нитроклетчатку, хлопок. Миколайчак утверждает, что ди-Н. не замерзает при обычных зимних температурах. К механическим импульсам ди-Н. гораздо менее чувствителен, чем три-Н.; зажженный он горит спокойно; при долговременном хранении не обнаружено никакого изменения или разложения его. Прибавление ди-Н. к три-Н. понижает его точку плавления и придает ему безопасность. Ввиду интереса, представляемого ди-Н., научно-техническая лаборатория морского вед. (СПб.) предприняла проверку синтеза и свойств этого тела. А. А. Зигельман получил из 100 гр. глицерина около 40 гр. продукта, растворимого в воде и представлявшего бесцветное масло с содержанием азота равным 13,64 % (для С3Н5(ОН)(NO3)2 — N = 15,38 %). Ввиду очевидной нечистоты продукта, была испробована перегонка вещества под уменьшенным давлением, однако, продукт при этом загорелся. В 1905 г. Миколайчак взял патент на приготовление прямым нитрованием смеси три- и ди-Н., которая не замерзает зимой. Образование такой смеси прямой нитрацией достигнуто уменьшением количества Н2SO4 и увеличением количества глицерина.П. Григорович.
Фиг. 1.Он состоит из свинцового сосуда А, помещенного в деревянном чане В и закрывающегося съемной свинцовой крышкою I, которая при работе замазывается цементом. Через крышку проходят: концы двух свинцовых змеевиков D, находящихся внутри аппарата и назначаемых для охлаждения смеси посредством протекающей через них холодной воды; трубки С, приводящей в аппарат сжатый холодный воздух для размешивания при работе; труба F, отводящая из аппарата пары азотной кислоты; термометры Е, из которых один доходит почти до дна, а другой погружен только в верхний слой жидкости; трубка G для наливания отмеренного количества кислотной смеси; трубка Н для приливания глицерина, согнутая у дна аппарата в кольцо, с мелкими отверстиями. Кроме того, в крышке несколько стеклянных оконцев L для наблюдения за явлениями, происходящими в аппарате. Подобное же оконце J устроено и в вытяжной трубе для наблюдения бурых паров окислов азота, образующихся в случаях развития в аппарате опасных реакций окисления или так наз. разложения Н. Сосуд M служит для отмеривания количества глицерина, определяемого по указательной трубке N, а также для впрыскивания его в кислотную смесь посредством сжатого (до 2 атмосф.) воздуха, впускаемого по трубки О. Через кран К жидкость выпускается из аппарата. Холодная вода при работе проводится не только через внутренний змеевик, но и через кольцеобразное пространство между свинцовыми и деревянными наружными станками. За один раз обрабатывают 150 кг глицерина. Впустив требуемое количество кислотной смеси и охладив ее (пропусканием холодного сжатого воздуха и током воды) до 15 — 20°, начинают вбрызгивание глицерина (с температурой не ниже 20°), регулируя приток его таким образом, чтобы нагревание в аппарате не поднималось выше 25 — 30°. Если температура продолжает повышаться, приближаясь к означенному пределу даже по прекращении притока глицерина, то усиливают пропускание холодного воздуха, а если и после того поднятие не останавливается, то содержимое аппарата быстро выпускается в большой чан с водой; в противном случае легко может начаться разложение H., могущее окончиться взрывом. Вся операция обработки глицерина кислотами, считая наполнение смесью и опоражнивание, требует не более 1 — 11/2 часа времени. Отделение Н. от кислот производится отстаиванием их смеси в так наз. сепараторе (фиг. 2).Фиг. 2.Это — свинцовый четырехугольный ящик с коническим дном, вставленный в такой же деревянный ящик А. В крышке находятся: вытяжная труба D с оконцем Е; трубка К для введения смеси из нитрационного аппарата; отверстие для вставления термометра и несколько оконцев. Такое же оконце J с плотно заделанным стеклом находится и на боковой стенке для наблюдения уровней кислоты и всплывающего Н. От конического дна сосуда идет трубка G с оконцем F и кранами Н. Всплывание Н. на поверхность кислот происходит легче, если по мере выделения спускать его через кран J в рядом стоящий промывочный чан L. Присутствие посторонних примесей, напр. жиров в глицерине, серно-кислого свинца и т. п., затрудняет выделение. При нормальных условиях, с чистыми материалами, операция продолжается около 30 мин. По окончании сливания почти всей массы Н. выпускают кислотную смесь через один из нижних кранов, пока в оконце F не появятся слой мутной смеси, состоящей из примесей и различных низших нитропродуктов. В этот момент закрывают кран и выпускают остаток смеси в подходящий сосуд для переноса в чан L. Низшие нитропродукты, образующиеся из самого глицерина или посторонних примесей, обладают меньшим уд. весом сравнительно с Н., всплывают на нем в виде пены и являются особенно склонными к разложению со значительным отделением тепла при действии воздуха. Это нужно иметь в виду при производстве отделения Н., так как присутствие означенной пены может вызвать разложение и внутри сепаратора; тогда в оконце Е появляются красно-бурые пары и температура начинает сама собой подниматься. В таких случаях содержимое выпускается через третий нижний кран в большой чан с водой, как при разложениях в нитрационном аппарате.Промывание Н., отделенного от избытка кислот, производится в два приема. Сначала подвергают его предварительной промывке в вышеупомянутом чане L. Это — цилиндрический свинцовый сосуд с наклонным дном и двумя кранами М, из которых нижний назначен для выпуска Н., а верхний для выливания воды. Перебалтывание производится помощью сжатого (до 2 атмосф.) воздуха, впускаемого по трубе N, которая внизу загнута и снабжена рядом мелких отверстий. Отстаивание, вследствие большой разницы уд. весов воды и Н., происходит быстро. Начальная температура воды должна быть ок. 15°, а во время приливания Н. не должна подниматься выше 30°. После первой промывки таким же образом производят вторую и третью; в последний раз промывают еще в 2,5% растворе соды, наливая этот раствор слоем в несколько сантиметров толщиной. Для окончательного удаления кислоты, Н. спускается в деревянные чаны, выложенные внутри свинцом и по своему устройству подобные предыдущему чану. Употребляя тройной объем воды, здесь производят от 10 до 18 промывок по 15 мин. каждую с перебалтыванием смеси с помощью сжатого воздуха (или механических мешалок); при 3-й и 5-й промывках вместо воды берется 1% раствор соды. Наиболее благоприятная температура воды 25 — 33°; на некоторых заводах первая промывка ведется при 50°. Продукт считается хорошо промытым, если он выдерживает нижеописанное испытание на стойкость при нагревании. Последняя операция при фабрикации состоит в фильтровании Н. для обезвоживания и удаления случайных твердых примесей. С этою целью его пропускают через специальные фильтры (фиг. 3).Фиг. 3.В крышку деревянного, выложенного внутри свинцом, цилиндрического сосуда А с наклоненным дном вставлен фильтрационный свинцовый цилиндр G; на нижнем крае его К лежит бронзовое кольцо L с сеткой M и войлоком; на них насыпается слой прокаленной поваренной соли О и сверху кладется еще войлок P со свинцовым кольцом Q; на верхний войлок надавливает груз R. С помощью ручек J фильтрационный цилиндр может легко выниматься для чистки его или осмотра внутренности сосуда. Такой фильтр, смоченный безводным H., не пропускает сквозь себя механически примешанную (эмульсированную) воду, последние же следы влаги (растворенной в Н.) поглощаются поваренной солью; с целью лучшего высушивания — к последней иногда прибавляют высушенный хлористый магний. В кислотной жидкости, отделенной от продукта, с течением времени может образоваться еще небольшое количество Н.; поэтому эта жидкость, прежде чем пустить ее на переработку для извлечения HNO3 и Н2SO4, подвергается предварительному отстаиванию (около недели) в больших сепараторах, устроенных подобно вышеописанному; всплывающий Н. время от времени сливается и подвергается обычному промыванию. С другой стороны, спускаемые промывные воды также уносят c собой некоторое количество продукта механически; для отделения и улавливания мелко раздробленного в этих водах Н., их пропускают через длинный свинцовый ящик с поперечными перегородками, снабженными вырезами попеременно, то внизу, то вверху (фиг. 4).Фиг. 4.Относительно извлекаемого при этих обеих операциях Н. нужно заметить, что он требует особенно тщательной промывки, так как в нем именно накопляются вышеупомянутые вредные низшие нитропродукты.2) Чистый Н., приготовленный из совершенно бесцветного глицерина с помощью чистых кислот, представляет маслянистую, бесцветную, как вода, жидкость, без запаха при обыкновенной температуре, со сладковатым, несколько жгучими вкусом; но полная, бесцветность редко получается, и обыкновенные его образчики бывают желтоватого или буроватого цвета. Очень ядовит; отравление может происходить не только при принятии внутрь и вдыхании паров, но и через кожу при простом прикосновении, и проявляется обыкновенно сильными головокружениями, головными болями, рвотой и т. п.; смертные случаи возможны при принятии внутрь значительных количеств (до 10 г). При легком отравлении страдания облегчаются посредством крепкого черного кофе и уксусно-кислого морфия (в очень малых дозах), но к такому отравлению рабочие на заводах привыкают и без видимого влияния на здоровье вскоре перестают ощущать болезненные припадки. На холоде Н. застывает в белую кристаллическую массу. Температура его плавления возрастает по мере увеличения чистоты: продукт обыкновенной очистки плавится при + 9° или + 10°, а перекристаллизованный несколько раз — при + 13,3°. Уд. вес в жидком состоянии 1,599, в твердом 1,735. Вода растворяет Н. в чрезвычайно малом количестве (около 0,003%), но он растворим во многих органических растворителях, напр. в спиртах метильном, этильном и амильном, ацетоне, в обыкновенном и уксусном эфире, уксусной кислоте, хлороформе, бензоле и т. п. Из очень крепких растворов в метиловом спирте, при охлаждении, можно кристаллизовать Н. и тем самым достигать наибольшего его очищения; кристаллизация происходит особенно легко, если в охлажденный до 0° раствор бросить готовый кристаллик его. Сам Н. растворяет в себе камфару, растворимый пироксилин (коллодий) и другие подобные вещества. В виде растворов в метиловом спирте Нобель, до открытия динамитов, предлагал перевозить и хранить Н., так как в таком состоянии он не чувствителен к случайным ударам, но прибавлением воды тотчас выделяется в осадок со всеми своими свойствами. Упругость паров Н. в пустоте: при 15° — 5 мм, при 87° — 27 мм, при 100° — 30 мм. Двухчасовая промывка в воде, нагретой до 50°, при пропускании сжатого воздуха, производит потерю 0,15% через испарение. Эти потери могут быть значительны, если в нагреваемых препаратах Н. находится в мелко раздробленном состоянии, напр. динамит, нагреваемый при 40° — 50° в. течение нескольких дней, иногда теряет до 10%. Хорошо промытый и высушенный Н. есть вещество постоянное, в течение неопределенно долгого времени — при температурах до 50°, а на более короткие промежутки времени — и при температурах до 100°. Но если он недостаточно чист (содержит кислоты), то может медленно разлагаться и при обыкновенной температуре: появляются бурые пары окислов азота, жидкость окрашивается в зеленоватый цвет и получает сильно кислую реакцию, образуются щавелевая и другие органические кислоты и т. п. В состоянии такого медленного разложения Н. легко взрывается от действия сравнительно слабых импульсов, и даже сам собой — вследствие местных самонагреваний. Новым промыванием такой начавший разлагаться продукт не всегда удается возвратить к первоначальному нормальному состоянию. Поэтому полнота очистки Н. при фабрикации имеет большое значение и должна быть всякий раз испытана. С этою целью обыкновенно производят два испытания — на нейтральность и стойкость при 65°. Первое осуществляется таким образом, что около 2 куб. см продукта взбалтывают в течение некоторого времени с 10 куб. см воды и, по отделении, определяют реакцию последней в присутствии фенолфталеина. Испытание стойкости при 65° производится, помещая около 3 г продукта в стеклянную трубочку с подвешенной на пробке и смоченной до половины полоской йодокрахмальной бумаги и определяя промежуток времени от начала вставления снаряженной трубочки в ванну с температурой 65° до момента появления бурого окрашивания на границе смоченной и несмоченной части полоски; такое окрашивание, появляющееся вследствие выделения йода из йодистого калия под влиянием образующихся окислов азота, не должно получаться ранее 10 или даже 30 минут. Чем чище продукт, тем продолжительнее его сопротивление нагреванию при этом испытании [Испытание на стойкость при 65° первоначально было применено Абелем к пироксилину и с тех пор известно под именем пробы Абеля. Показания этой пробы зависят от условий, а именно: а) йодокрахмальная бумага должна быть приготовлена из чисто промытой шведской фильтровальной бумаги, напитывая последнюю смесью растворов 3 г крахмала в 250 куб. см воды и 1 г йодистого калия в 250 куб. см воды; после высушивания при обыкновенной температуре листы разрезаются на полоска 12×15 мм и сохраняются в герметических банках из темного стекла, б) пробирные трубочки, длиной 14 см и шириной 16 мм, должны плотно закрываться пробками, снабженными снизу крючочками для подвешивания йодокрахмальных бумажек; в) смачивание верхней половины бумажных полосок производится 10% раствором чистого глицерина; г) при испытаниях снаряженные трубочки настолько вдвигаются в ванну, чтобы йодокрахмальные бумажки приходились тотчас над крышкой ванны]. Но для полного суждения о чистоте Н. требуется еще испытать его в отношении состава. Последнее на практике сводится собственно к определению в нем влажности и азота. Определение влажности производится оставлением навески Н. надолго при обыкновенной темп. в пустоте над хлористым кальцием, а азот определяется обыкновенно помощью нитрометра (см.); в совершенно чистом и сухом продукте должно содержаться около 18,5% азота, т. е. такое количество, которое требуется самой формулой Н. Производя нагревание весьма малых количеств осторожно, можно перегнать Н. без разложения, напр. помещая каплю его на умеренно нагретую металлическую пластинку. Но если пластинка будет нагрета настолько, что Н. тотчас же приходит в кипение, то капля взрывается. По опытам Шампиона весьма малые количества Н. при высоких температурах вообще содержатся следующим образом: при 185° — кипение с выделением бурых паров; при 194° — медленное улетучивание; при 200° — быстрое улетучивание; при 218° — быстрое сгорание; при 241° — взрыв (трудный); 257° — сильный взрыв; при 267° — слабый взрыв; при 287° — еще более слабый взрыв с пламенем. При красном калении капля Н. принимает сфероидальное состояние и улетучивается без взрыва. По Коппу, на накаленной докрасна металлической пластинке происходит слабая вспышка. Но другие явления получаются, когда подвергнуты действию высоких температур значительные количества Н. Сначала совершается в течение более или менее короткого промежутка времени медленное разложение с выделением бурых паров и улетучиванием части самого продукта, но как только температура вследствие самонагревания или принятия теплоты от ванны повышается до 180° (приблизительно), и разлагающаяся жидкость закипает, то тотчас же наступает сильный взрыв всей взятой массы. Горящие и накаленные тела весьма трудно воспламеняют Н.: зажженная спичка в нем тухнет, накаленная платиновая проволока перестает испускать свет, и т. п. Но раз зажженный, он сгорает постепенно, пока температура остальной массы не повысится до 160°, и тогда наступает общий взрыв. Гораздо легче нитроглицерин взрывается от удара. При ударе на наковальне молотком взрывается собственно часть, подвергшаяся непосредственно удару, соседние же части разбрасываются без взрыва; величина необходимой для этого работы определена в 0,75 килограммометра. Замороженный Н. менее чувствителен к удару; в этом состоянии для взрыва ему требуется сообщить работу удара почти в 3 раза большую. Лучшим средством для взрывания Н. при его употреблении является воспламенение капсюля с гремучей ртутью (0,1 — 0,3 г для жидкого и 1 — 2 г для замороженного) в непосредственном прикосновении с зарядом. При взрыве происходит разложение согласно уравнению:2CЗH5(NO3)3 = 6CO2 + 5H2O + 3N2 + 0,5O2т. е. образуется: водяной пар, углекислота, азот и кислород. Этот кислород стараются утилизировать в динамитах (см.) с деятельным поглотителем. Отсутствие окиси углерода делает продукты взрыва совершенно безвредными, что особенно ценно при подземных взрывных работах. Об объеме образующихся газов, количестве отделяющегося тепла, скорости распространения взрыва в больших зарядах, силе и т. п. см. соотв. статью По отношению к различным химическим реагентам Н. содержится подобно другим азотным эфирам: щелочами обмыливается, кислотами разлагается с выделением азотной кислоты, восстановителями превращается обратно в глицерин с выделением окиси азота или аммиака. Для открытия самых малых количеств Н. прибавляют к испытуемой жидкости анилина и концентрированной серной кислоты: получается пурпурово-красное окрашивание, которое при разбавлении водой переходит в зеленое (Вербер).И. М. Чельцов. Δ.Н. (мед.). При вдыхании паров, равно как после смазывания языка, Н., в малых дозах, вызывает головную боль, тошноту, головокружение, ощущение жара и учащенное сердцебиение; после внутреннего употребления более значительных доз наблюдались головная боль, дрожание, мышечная слабость, доходившая до полного паралича, отдышка, в некоторых случаях смертельного отравления — резкое расстройство дыхания, синюха и глубокое угнетение нервной системы. Несмотря на эти опасные свойства, Н., употребляющийся в гомеопатии при различных нервных заболеваниях (под названием "глоноина"), сравнительно недавно предложен как средство против невралгий, в особенности против припадков грудной жабы; далее, препарат этот испробован при бронхиальной астме, в некоторых случаях мигрени, при падучей, пляске св. Витта, и при остром и хроническом воспалении почек. Н. назначают по 0,0002 — 0,001 г несколько раз в день или в каплях, от 1 до 5 капель в 1% масляном или алкогольном растворе; средство это приготовляют также в пастилках.Д. К.II (дополнение к статье)После введения Н. в технику взрывчатых веществ выяснились большие неудобства в пользовании этим веществом. При замерзании Н. в динамитах значительно повышается чувствительность их к удару; целый ряд несчастных случаев был за последнее десятилетие вызван этим свойством Н. 11-го декабря 1902 года произошел от этой причины при разгрузке взрыв 1000 кг. динамита в руднике Гнейзенау (Дортмунд), повлекший за собой гибель массы людей и построек. Повторение этих случайностей вызвало созыв в 1903 году интернационального конгресса по прикладной химии, состоявшегося в Берлине; этот конгресс (профф. Вилль, Мейсснер, Гейзе, Денкер) выяснил, что замерзание Н. представляет неустранимую опасность, тем более, что даже при, температуре + 12°Ц. Н. остается твердым. Попытки устранить замерзание Н. прибавлением нитробензона, камфоры, терпентина, азотнокислого амила не удались. А. Миколайчак предложил (1904 г.) заменить Н. ди-Н., который представляет двуазотный эфир глицерина, C3H5(OH)(ONO2)2 и до этого еще не был получен. Способ получения ди-Н по патенту (1904) таков. К 10 ч. глицерина прибавляют 33 ч. азотной кислоты уд. в. 1,5 при непрерывном помешивании и охлаждении. Смесь поддерживают при темп. 10° Ц., разбавляют 10 частями воды и нейтрализуют СаСО3. При стоянии большая часть ди-Н. всплывает на поверхность и может быть механически отделена; растворенная часть может быть извлечена эфиром. Ди-Н. представляет бесцветное прозрачное масло, растворимое в воде и три-Н.; растворяет и желатинирует нитроклетчатку, хлопок. Миколайчак утверждает, что ди-Н. не замерзает при обычных зимних температурах. К механическим импульсам ди-Н. гораздо менее чувствителен, чем три-Н.; зажженный он горит спокойно; при долговременном хранении не обнаружено никакого изменения или разложения его. Прибавление ди-Н. к три-Н. понижает его точку плавления и придает ему безопасность. Ввиду интереса, представляемого ди-Н., научно-техническая лаборатория морского вед. (СПб.) предприняла проверку синтеза и свойств этого тела. А. А. Зигельман получил из 100 гр. глицерина около 40 гр. продукта, растворимого в воде и представлявшего бесцветное масло с содержанием азота равным 13,64 % (для С3Н5(ОН)(NO3)2 — N = 15,38 %). Ввиду очевидной нечистоты продукта, была испробована перегонка вещества под уменьшенным давлением, однако, продукт при этом загорелся. В 1905 г. Миколайчак взял патент на приготовление прямым нитрованием смеси три- и ди-Н., которая не замерзает зимой. Образование такой смеси прямой нитрацией достигнуто уменьшением количества Н2SO4 и увеличением количества глицерина.П. Григорович.
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — С.-Пб.: Брокгауз-Ефрон. 1890—1907.



