- Бром, химический элемент
-
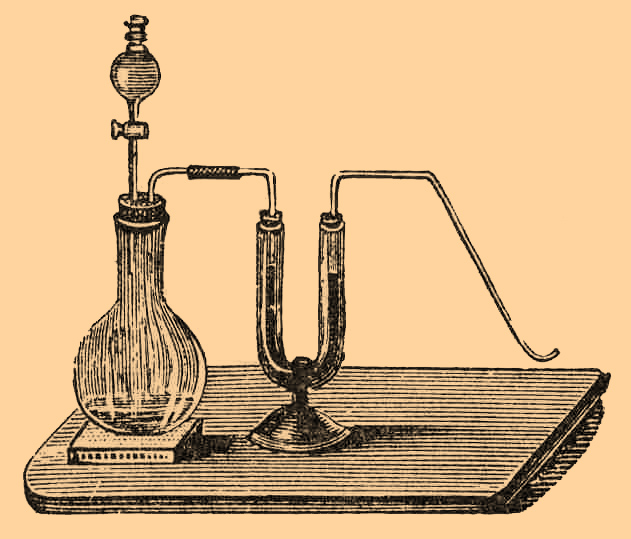
(Bromum; хим. форм. Br, атомный вес 80) — неметаллический элемент, из группы галоидов, открытый в 1826 г. французским химиком Баларом в маточных растворах солей морской воды; название свое Б. получил от греческого слова Βρωμος — зловоние. Одновременно с Баларом, по словам Ландольта, Б. был получен Лёвигом из маточных растворов солей крейцнахских источников; но в то время, когда Лёвиг занялся приготовлением вещества в больших количествах, появилась работа Балара. Б. никогда не встречается в природе в свободном состоянии, а лишь в соединении с различными металлами. Вместе с хлором (и йодом) он содержится в морской воде (в виде бромистого натрия и магния); но количество его здесь незначительно: на 1 литр приходится около 0,06 г Б. (однако в Мертвом море, на глубине 300 метров, содержание его доходит до 7 г на литр). Гораздо богаче бромом маточные растворы, получающиеся при добыче поваренной соли в некоторых местностях (Шёнебек, близ Магдебурга, соляные заводы Пенсильвании и др.) или при добыче солей калия, в Стассфурте и Леопольдсгалле. Стассфуртские копи, вместе с некоторыми американскими источниками, доставляют главную массу брома. Б. затем найден во многих минеральных водах (крейцнахских, старорусских и др.); в Чили и Мексике он встречается в виде бромистого серебра; чилийская селитра также содержит небольшие количества Б.; наконец, в золе морских водорослей присутствуют, между прочим, и бромистые металлы. Добычу Б. в заводских размерах производят следующим образом: маточные растворы, содержащие бромистые металлы, обрабатывают в каменных сосудах перекисью марганца и серной кислотой, в струе водяного пара; пары Б. и воды идут по свинцовой трубке в змеевик со стеклянным форштосом, а оттуда в трехгорлую вульфову склянку, служащую приемником; в начале операции гонится почти чистый Б., затем начинает выделяться хлористый Б., а под конец разложения появляется свободный хлор. По цвету газов в стеклянном форштосе легко различить эти три фазы операции; гонку следует прекращать, лишь только начнут выделяться желтые пары хлористого Б. Не успевший сгуститься Б. отводят в особый сосуд с водой и железными стружками, где и происходит окончательное поглощение. Чтобы по возможности избежать примеси хлора, маточные растворы обрабатывают предварительно слабой серной кислотой, при чем выделяются соляная и бромисто-водородная кислоты; смесь нагревают при 120°; соляная кислота удаляется в виде газа, а бромистый водород остается в растворе; кислую жидкость отделяют от осевших серно-кислых солей и обрабатывают серной кислотой и перекисью марганца; пары Б. отводят сначала в пустую вульфову склянку, а затем в сосуд с раствором едкого натра, где они и поглощаются, образуя бромистый натрий и бромновато-натриевую соль; раствор выпаривают досуха, остаток прокаливают и получают из него обычным путем чистый Б. Для добычи Б. устраивают также сложные аппараты, действующие непрерывно; такого рода приспособление имеется, напр., на заводах в Леопольдсгалле; сущность его заключается в том, что навстречу маточному раствору, падающему в виде мелкого дождя сверху, в особой башне, направляется с известной силой струя водяных паров и хлора; этот последний вытесняет Б., который отводится по особой трубке, помещенной в верхней части башни, в приемник, а обработанный раствор стекает вниз, где в особо приспособленной камере, лишается при помощи струи водяного пара небольших количеств свободного Б. и хлора и затем отводится наружу; остатки Б., хлор и водяной пар своим чередом непрерывно идут опять в башню, действуют на новое количество раствора, и таким путем процесс идет непрерывно. Полученный на заводах Б. не представляет чистого вещества, а содержит главным образом в виде примеси хлор (собственно хлористый Б.), а также йод; этого последнего нет в продажном стассфуртском Б. Хлор удаляют, промывая Б. водой, затем сушат промытое вещество серной кислотой и перегоняют с термометром, собирая порцию, кипящую при 58°; для удаления йода полученный этим путем Б. переводят в бромистый калий, растворяют его и обрабатывают раствор бромом, при чем выделяется йод, который извлекают взбалтыванием с сернистым углеродом. Из очищенного таким образом бромистого калия уже легко приготовить чистый Б., не содержащий йода. Если растворить Б. в крепком растворе бромистого кальция и обработать все водой, то осаждается Б., не содержащий хлора. Чистый Б. представляет темно-бурую жидкость, почти черную в толстом слое, выделяющую красно-бурые пары; запах его удушливый, едкий, сходный с запахом хлора; пары сильно разъедают слизистые оболочки носа и дыхательных органов. Уд. вес Б. при 0° — 3,1872 (Пьерр), при 15° — почти 3,0; температура кипения 58,7°; замерзает при охлаждении в буроватую кристаллическую массу, плавящуюся при — 7° (Рамзай и Юнг); в воде растворим; на 1 часть Б. при 5° требуется 27 ч. воды, при 15° — 29 ч. Водный раствор Б. имеет оранжевый цвет и носит название бромной воды; при охлаждении из раствора выделяются красные кристаллы соединения, содержащего 10 частиц воды на частицу брома: Br2 + 10Н2О. Температура полного распадения этого гидрата + 6,2° (Б. Розебом).Б. хорошо растворим в эфире, хлороформе, сероуглероде и может быть извлечен этими жидкостями из водных растворов; растворы бромистого калия, бромисто-водородной и соляной кислоты также растворяют значительные количества Б. Вместе с хлором, йодом и фтором Б. составляет естественную группу галоидов и занимает по химическим свойствам середину между хлором и йодом; подобно прочим своим аналогам, Б. прямо соединяется с металлами, образуя соли; с водородом дает одноосновную бромисто-водородную кислоту; способен замещать водород и с кислородом образует окислы кислотного характера. Если водный раствор Б. выставить на солнечный свет, то бурая окраска жидкости постепенно пропадает; появляется кислая реакция, и весь Б. вступает в соединение с водородом воды, а кислород становится свободным:Н2О + Br2 = 2HBr + О.Этой реакцией обусловливаются окислительные свойства Б. в присутствии воды. В тех или других условиях Б. способен прямо вступать в соединение со многими элементами (но не с углеродом и кислородом), иногда с выделением большого количества тепла. С хлором Б. дает жидкий, летучий хлористый Б.; при действии Б. на крепкие растворы щелочей образуются бромистые металлы и бромновато-кислые соли; водный раствор аммиака разлагается с выделением свободного азота и бромистого аммония; с органическими веществами Б. или прямо соединяется, или же дает продукты замещения с образованием бромистого водорода; обесцвечивает красящие вещества, напр. индиго, лакмус и т. п. Б. легко отличить от других веществ по буро-красному цвету паров, характерному запаху и по растворимости в сероуглероде и хлороформе с бурой (или желтой) окраской; поэтому при качественном анализе Б. обыкновенно выделяют из соединений в свободном состоянии перекисью марганца и серной кислотой или, лучше, хлорной водой. Количественно свободный Б. определяется при помощи титрования: испытуемую жидкость смешивают с определенным объемом титрованного раствора йодистого калия и затем определяют титрованием количество вытесненного йода. В бромисто-водородной кислоте и ее солях Б. определяется, в виде бромистого серебра, осаждением раствора азотно-серебряной соли (ляписа); в органических соединениях определение совершается, в сущности, тем же путем; только здесь необходимо разложить вещество, в присутствии ляписа, нагреванием (выше 100°С) с крепкой азотной кислотой в запаянных трубках; весь Б. получается при этом в виде бромистого серебра (способ Кариуса). Помимо общеизвестного употребления в медицине и фотографии (в виде различных препаратов, преимущественно бромистого калия), Б. имеет широкое применение в лабораторной практике; он во многих случаях с выгодой может заменять хлор, и притом обращаться с жидким бромом гораздо удобнее, чем с газообразным хлором. В заводской практике бромистый этил, бромистый амил и бромистый метил служат для получения некоторых органических красок; с 1874 г. Б. идет на приготовление эозина (тетрабромфлюоресцеина); по Рейхардту, для приготовления соли Гмелина K3FeCl6, вместо хлора, с выгодой можно пользоваться бромом, и т. п. Добыча Б., производившаяся ранее в Европе в небольших сравнительно, размерах получила сильное развитие с тех пор, как А. Франк в 1865 г. стал получать Б. из маточных растворов стассфуртских солей. Стассфурт и Леопольдсгалль доставляют ежегодно около 300 тонн, Северная Америка до 200 тонн брома.Бромисто-водородная кислота, бромистый водород, HBr. Бром соединяется с водородом только при высокой температуре или при действии электрических искр; при обыкновенной температуре, даже на солнечном свету, соединения не происходит. Бромистый водород был получен впервые Баларом, открывшим и Б.; он весьма сходен с хлористым водородом, однако не может быть приготовлен в чистом виде, подобно этому последнему, при действии серной кислоты на бромистый калий, так как часть бромистого водорода разлагается серной кислотой с выделением Б., а серная кислота, в свою очередь, восстановляется до сернистого газа. Впрочем, употребляя кислоту определенной концентрации этим путем можно с удобством готовить водную 48-процентную бромисто-водородную кислоту, очищаемую перегонкой ("Chemiker-Zeit", 1891 г., № 26, стр. 444). Если серную кислоту заменить фосфорной, которую бромистый водород не способен восстановлять, то выделяющийся газ не содержит примеси Б. Обыкновенно бромистый водород готовят, приливая 10 частей Б. к смеси 1 ч. аморфного фосфора с 2 частями воды. При этом образуется бромистый фосфор, который водой разлагается с выделением бромистого водорода. Операцию ведут в приборе, представленном на рисунке:Колба, содержащая фосфор и воду, закупорена пробкой с двумя отверстиями; в одно из них плотно вставлена делительная воронка с краном, через которую, по каплям, приливают Б., а в другое — газоотводная трубочка, соединенная с так называемой U-образной трубкой, наполненной кусками обыкновенного фосфора и стекла, смоченного водой. Желтый фосфор предназначается для поглощения паров Б., увлекаемых током бромистого водорода. Вначале каждая капля Б. вызывает бурную реакцию, даже с выделением света, но затем газ идет равномерно и спокойно; его собирают над ртутью или же, для получения водного раствора кислоты, пропускают в воду. При обработке бромом парафина, нагретого до 185°, выделяются значительные количества бромистого водорода Г. Г. Густавсон, в своей докторской диссертации, дает следующий способ получения сухого газа: на продажный антрацен (см.) действуют бромом, приливая его понемногу из воронки с краном. Нагревания не требуется. Для устранения паров Б., бромистый водород пропускают через трубку, наполненную чистым антраценом, а для окончательного высушивания — через трубку, наполненную смесью фосфорного ангидрида и асбеста. Чистый бромистый водород представляет бесцветный газ, кислого вкуса, по запаху напоминающий соляную кислоту, во влажном воздухе распространяющий тяжелый белый дым, вследствие образования паров водной кислоты; при 73° Б. сгущается в бесцветную жидкость, которая, при испарении, отчасти затвердевает в кристаллы (Фарадей). Уд. вес газа 2,797; вода жадно поглощает его с выделением большого количества тепла. Помимо насыщения воды газообразным бромистым водородом, раствор можно также готовить, приливая 10 ч. Б. к смеси 1 ч. красного фосфора с 15 ч. воды и перегоняя затем полученную водную кислоту. При перегонке сначала идет очень слабая бромисто-водородная кислота, но когда содержание газа в растворе достигнет почти 48%, то гонится постоянно кипящий раствор (126°С) указанной концентрации; он отвечает формуле HBr + 5Н20. Более крепкие растворы выделяют при нагревании избыток газа и опять дают тот же раствор с т. к. 126°. Крепкая водная кислота дымит на воздухе; уд. вес 82-процентной кислоты, отвечающей по составу формуле HBr + H2O, равен 1,78; уд. вес 47,87-процентной (HBr + 5Н2О) при 14°—1,485. (Топсое). При пропускании через раскаленную трубку (700°) бромистый водород не разлагается; хлор легко вытесняет из него Б.; некоторые металлы, многие окиси, гидраты окисей и углекислые соли растворяются в водной кислоте с образованием бромистых металлов; бромноватая кислота дает с ней Б. и воду; в смеси с азотной кислотой бромисто-водородная способна растворять платину и золото.Бромистые соединения. Как уже было указано выше, Б. прямо соединяется со многими элементами, образуя более или менее прочные бромистые соединения, которые могут быть также получены косвенными путями, при действии Б. или бромистого водорода на различные вещества. Так, напр., углекислые и едкие щелочи, а также окиси щелочноземельных металлов при накаливании разлагаются бромом с выделением бромистых металлов; в водных растворах реакция идет иначе: кислород не выделяется, а получаются бромновато-кислые (и бромноватисто-кислые) соли; калий, натрий, олово разлагают бромисто-водородный газ, а железо, цинк и т. п., а также окиси многих металлов легко растворяются в водной кислоте, с образованием бромистых металлов. Подробнее образование и свойства важнейших бромистых соединений будут изложены при описании соответственных элементов. В органической химии бромистыми соединениями называются вещества, образующиеся присоединением Б. к непредельным соединениям или атомным группам известного строения; таковы, например, будут: бромистый этилен, С2H4Br (см. Этилен), бромистый стильбен, С14H12Br2 (см. Стильбен), бромистый метил, СН3Br (см. Болотный газ), бромистый бензилиден, C6H5CHBr2 и т. п.Бромосоединениями называются продукты замещения галоидом, напр. бромбензол, С6Н5Br (см. Бензол), бромэтилен, C2H3Br (см. Этилен), пербромэтан, C2Br6 (см. Этан) и т. п.Бромноватистая кислота. BrOH. При действии Б. на слабые водные растворы щелочей образуются, наряду с бромистыми металлами, соли бромноватистой кислоты, которые, однако, невозможно выделить из раствора вследствие их чрезвычайной непрочности. При обработке окиси ртути бромной водой получается светло-желтый раствор бромноватистой кислоты, также весьма легко разлагающийся (Балар). Кислота и ее соли обладают белящими свойствами. В аналитической химии щелочной раствор брома употребляют для определения азота в мочевине (см.) и тому подобных соединениях, выделяющих при действии этого реактива весь азот в виде газа.Бромноватая кислота — HBrO3. При действии брома на крепкие растворы щелочей образуется смесь солей бромисто-водородной и бромноватой кислоты, по уравнению:6Br + 6KOH = 5KBr + KBrO3 + 3Н2О;Калийная и бариева соли ее трудно растворимы в воде и выпадают при вышеприведенной реакции в виде кристаллического порошка; кристаллизацией из горячей воды они окончательно очищаются от примесей. Если на бромновато-серебряную соль, получающуюся в виде белого осадка при двойном разложении раствора соли калия с азотно-кислым серебром, действовать бромом и водой, то получается бесцветный водный раствор бромноватой кислоты, который может быть сгущен в пустоте до содержания 50,59% HBrO3; по составу такая кислота отвечает гидрату HBrO3 + 7Н2О. (Кеммерер). Бромноватая кислота образуется также и другими путями, напр. при разложении (нагреванием) бромноватистой кислоты с выделением брома, при действии электрического тока на бромную воду и т. д. Вещество разлагается при нагревании на бром, кислород и воду и действует сильно окисляющим образом на различные соединения: сернистый газ окисляется до серной кислоты, из сернистого водорода выделяется сера и т. п.; хлор на вещество не действует; йод разлагает его с выделением йодноватой кислоты. Бромноватая кислота одноосновна и дает только один ряд солей, которые при нагревании разлагаются, частью с выделением кислорода и бромистых металлов, а частью сверх того еще с выделением брома и образованием окисей; при нагревании на угле происходит вспышка. По этим реакциям, а также по окислительным свойствам, легко открыть присутствие бромноватой кислоты и ее солей.Ср. Balard, "Mém. sur une substance particulière contenue dans l'eau de la mer" ("Ann. de Chim. et de Phys", 32, стр. 337); Löwig, "Das Brom und seine chemische Verhältnisse" (Гейдельберг); 1829; A. W. Hofmann, "Bericht über die Entwickelung d. Chem. Industrie etc." (стр. 127, Брауншвейг, 1875); Kerl und Stohmann (Muspratt), "Handbuch d. Techn. Chemie", 4-е изд.В. Р. и М. Л.Бром (фальс.). В продажном Б. встречаются след. примеси: хлор, йод, бромоформ, четырехбромистый углерод и бромистый циан. Примесь хлора определяется следующим образом: Б. взбалтывают с водой, образовавшийся водный раствор Б. сливают и насыщают баритовой водой, избыток барита удаляют током углекислого газа; потом выпаривают досуха, остаток прокаливают и по охлаждении обрабатывают безводным алкоголем, который растворяет только бромистый барий, фильтруют, и на фильтре будет хлористый барий, если в Б. была примесь хлора. На фильтр наливают горячей воды, хлористый барий растворится, и к фильтрату прибавляют раствора азотно-кислого серебра; образовавшийся белый осадок хлористого серебра укажет на присутствие хлора в Б. Примесь йода в Б. легко узнается таким способом: в стаканчик наливают дистиллированной воды, кладут туда несколько кусочков железной чистой проволоки и прибавляют несколько капель испытуемого Б. Образуется йодистое железо, и прибавка в стаканчик раствора крахмала вызовет синее окрашивание всей жидкости. Поссельже (Posselger) находил в продажном Б. до 8% бромоформа; эта примесь изменяет точку кипения Б., а именно, он кипит тогда при 120°, и после испарения Б. на стеклышке остается твердый углистый остаток. Вода растворяет такой нечистый Б. в гораздо меньшем количестве, чем чистый. Примесь четырехбромистого углерода нашел Гамильтон (Hamilton), который рекомендует открывать ее перегонкой маленькой порции Б.; такой Б. закипает при 80°, и после удаления его в колбочках остается белый кристаллический осадок, плавящийся при 90°. Фипсон (Phipson) определяет присутствие циана в Б. таким способом: в стаканчик кладут несколько кусочков железной проволоки и наливают в пять раз больше (по весу) дистиллированной воды, прибавляют немного Б., размешивают и быстро фильтруют; через несколько минут из фильтрата начинает выделяться берлинская лазурь.А. А—н.
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — С.-Пб.: Брокгауз-Ефрон. 1890—1907.