- Купоросное масло
-
Серная кислота 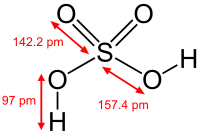
Общие Систематическое наименование серная кислота Химическая формула H2SO4 Отн. молек. масса 62.03 а. е. м. Молярная масса 98.078 г/моль Физические свойства Плотность вещества 1,8356 г/см³ Состояние (ст. усл.) бесцветная маслянистая жидкость без запаха Термические свойства Температура плавления 10,38 °C Температура кипения 279,6 °C Химические свойства Растворимость в воде смешивается во всех соотношениях г/100 мл Классификация номер CAS 7664-93-9
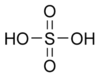
Се́рная кислота́ H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом. Если молярное отношение SO3:H2O < 1, то это водный раствор серной кислоты, если > 1, — раствор SO3 в серной кислоте.Содержание
Физические и физико-химические свойства
Очень сильная двухосновная кислота, при 18оС pKa= −2,8, К₂ 1,2 10², pKa= 1,92; длины связей в молекуле S=O 0,143 нм, S—OH 0,154 нм, угол HOSOH 104°, OSO 119°; кипит, образуя азеотропную смесь (98,3 % H2SO4 и 1,7 % H2O с температурой кипения 338,8оС). Серная кислота, отвечающая 100%-ному содержанию H2SO4, имеет состав (%): H2SO4 99,5, HSO₄- — 0,18, H₃SO₄+ — 0,14, H₃O+ — 0,09, H₂S₂O₇, — 0,04, HS₂O₇⁻ — 0,05. Смешивается с водой и SO₃, во всех соотношениях. В водных растворах серная кислота практически полностью диссоциирует на H+, HSO4-, и SO₄2-. Образует гидраты H2SO4·nH2O, где n = 1, 2, 3, 4 и 6,5.
Олеум
Растворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два соединения H2SO4·SO3 и H2SO4·2SO3. Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
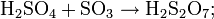
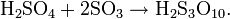
Температура кипения водных растворов серной кислоты повышается с ростом ее концентрации и достигает максимума при содержании 98,3 % H2SO4.Свойства водных растворов серной кислоты и олеума Содержание % по массе Плотность при 20, г/см³ Температура плавления, ℃ Температура кипения, ℃ H2SO4 SO3 (свободный) 10 - 1,0661 −5,5 102,0 20 - 1,1394 −19,0 104,4 40 - 1,3028 −65,2 113,9 60 - 1,4983 −25,8 141,8 80 - 1,7272 −3,0 210,2 98 - 1,8365 0,1 332,4 100 - 1,8305 10,4 296,2 104,5 20 1,8968 −11,0 166,6 109 40 1,9611 33,3 100,6 113,5 60 2,0012 7,1 69,8 118,0 80 1,9947 16,9 55,0 122,5 100 1,9203 16,8 44,7 Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3, в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
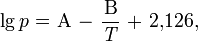
величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация:
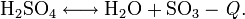
Уравнение температурной зависимости константы равновесия:
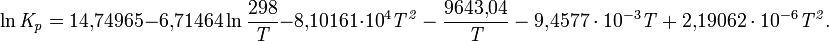
При нормальном давлении степень диссоциации: 10⁻⁵ (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К).
Плотность 100%-ной серной кислоты можно определить по уравнению:
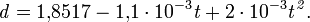
С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO³ увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается:
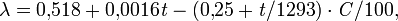
где С — концентрация серной кислоты, в %.
Максимальную вязкость имеет олеум H₂SO₄·SO₃, с повышением температуры η снижается. Электрическое сопротивление серной кислоты минимально при концентрации 30 и 92 % H2SO4 и максимально при концентрации 84 и 99,8 % H₂SO₄. Для олеума минимальное ρ при концентрации 10 % SO₃. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10⁻⁵T3/2 см²/с.
Химические свойства
Серная кислота — довольно сильный окислитель, особенно при нагревании; окисляет HI и частично HBr до свободных галогенов, углерод до CO2, S — до SO2, окисляет многие металлы (Cu, Hg и др.). При этом серная кислота восстанавливается до SO₂, а наиболее сильными восстановителями — до S и H₂S. Концентрированная H₂SO₄ частично восстанавливается H₂. Из-за чего не может применяться для его сушки. Разбавленная H₂SO₄ взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода, с выделением H₂. Окислительные свойства для разбавленной H₂SO₄ нехарактерны. Серная кислота дает два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.
Применение
Серную кислоту применяют:
- в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513(эмульгатор);
- в промышленном органическом синтезе в реакциях:
- дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (этанол из этилена);
- сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
- алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.
Самый крупный потребитель серной кислоты — производство минеральных удобрений. На 1 т P₂O₅ фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH₄)₂SO₄ — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Токсическое действие
Серная кислота и олеум — очень едкие вещества. Они поражают кожу, слизистые оболочки, дыхательные пути (вызывают химические ожоги). При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. ПДК аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м³, в атмосферном воздухе 0,3 мг/м³ (максимальная разовая) и 0,1 мг/м³ (среднесуточная). Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин). Класс опасности II. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды S, и выпадать в виде кислотных дождей.
Исторические сведения
 молекула серной кислоты по Дальтону
молекула серной кислоты по ДальтонуСерная кислота известна с древности. Первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
Позже, в 9 веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усоверщенствовал европейский алхимик Альберт Магнус, живший в 13 веке.
В 15 веке алхимики обнаружили, что серную кислоту можно получить, сжигая смесь серы и селитры, или из пирита — серного колчедана, более дешевого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах. И только в середине 18 столетия, когда было установлено, что свинец не растворяется в серной кислоте, от стеклянных лабораторий перешли к большим свинцовым камерам.
Дополнительные сведения
Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (п-ов Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже[1]. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3·107 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994 [2].
Облака серной кислоты, предположительно, составляют значительную часть облачного покрова Венеры.
Статья "Серная кислота" (Химическая энциклопедия)
Плотность и значение pH серной кислоты при t=20°C
Серная кислота: химические и физические свойства
Растворимость двуокиси серы в растворах серной кислоты
Растворимость двуокиси серы в концентрированной серной кислоте и олеуме
Поверхностное натяжение (в дин/см) растворов серной кислоты
Растворимость закиси азота N2O в растворах серной кислоты
Растворимость окиси азота NO в растворах серной кислоты
Свойства гидратов серной кислоты
Удельная электропроводность х водных растворов серной кислоты и температурный коэффициент аt
Давление пара (р, мм рт. ст.) различных форм твердой трехокиси серы
Растворимость двуокиси серы при рSO2 = 1 атм
Степень электролитической диссоциации водных растворов серной кислоты
Общее давление паров (в мм рт. ст.) над растворами серной кислоты
Растворимость фтористого водорода (в масс. %) во фторсульфоновой и серной кислотах
Серная кислота (статья из БСЭ, 1970 г.)
Предприятия-поставщики серной кислоты (часть I)
Предприятия-поставщики серной кислоты (часть II)
Серная кислота (поиск среди поставщиков химических реактивов для лабораторий)
Получение серной кислоты
Полная статья: производство серной кислоты.
Стандарты
- Кислота серная техническая ГОСТ 2184—77
- Реактивы. Кислота серная. Технические условия ГОСТ 4204—77
Примечания
- ↑ см. статью «Вулканы и климат»(рус.)
- ↑ [1](рус.)
Литература
- Справочник сернокислотчика, под ред. К. М. Малина, 2 изд., М., 1971;
Wikimedia Foundation. 2010.
