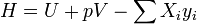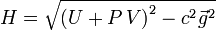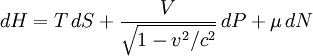- Инвариантная энтальпия
-
Термодинамические потенциалы 
Статья является частью серии «Термодинамика». Внутренняя энергия Энтальпия Свободная энергия Гельмгольца Энергия Гиббса Большой термодинамический потенциал (Ω) Разделы термодинамики Начала термодинамики Уравнение состояния Термодинамические величины Термодинамические потенциалы Термодинамические циклы Фазовые переходы править Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц. Количество термодинамической энергии, содержащееся в веществе.
Если термомеханическую систему рассматривать как состоящую из макротела (газа) и поршня с грузом Р = p S, уравновешивающего давление газа р внутри сосуда, то такая система называется расширенной.
Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом Eпот = pSx = pV
- H = E = U + pV
Таким образом, энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии. Энтальпия системы H — аналогично внутренней энергии — имеет вполне определенное значение для каждого состояния, т. е. является функцией состояния. Следовательно, в процессе изменения состояния
- ΔH = H2 − H1
Энтальпией системы удобно пользоваться в тех случаях, когда в качестве независимых переменных, определяющих состояние системы, выбирают давление р и температуру Т
- H = H(p,T)
Энтальпия — величина аддитивная, т. е. для сложной системы равна сумме энтальпий её независимых частей
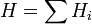 .
.Энтальпия определяется с точностью до постоянного слагаемого, которому в термодинамике часто придают произвольные значения (например, при расчете и построении тепловых диаграмм). При наличии немеханических сил величина энтальпии системы равна
где Xi — обобщённая сила; yi — обобщённая координата.
Изменение энтальпии не зависит от пути процесса, так как изменение объёма при постоянном давлении определяется только начальным и конечным состоянием системы.
Если система каким-либо путём возвращается в исходное состояние (круговой процесс), то изменение любого её параметра равно нулю, а отсюда ΔU = 0 и ΔH = 0.
Примеры: Неорганические соединения (при 25 °C)
Стандартная энтальпия реакции
Хим соединение Фаза (вещества) Хим формула Δ Hf0 кДж/моль Аммиак aq NH3 (NH4OH) −80.8 Аммиак g NH3 −46.1 Натрия карбонат s Na2CO3 −1131 Натрия хлорид (соль) aq NaCl −407 Натрия хлорид (соль) s NaCl −411.12 Натрия хлорид (соль) l NaCl −385.92 Натрия хлорид (соль) g NaCl −181.42 Гидроксид натрия aq NaOH −469.6 Гидроксид натрия s NaOH −426.7 Нитрат натрия aq NaNO3 −446.2 Нитрат натрия s NaNO3 −424.8 Диоксид серы g SO2 −297 Серная кислота l H2SO4 −814 Кремния диоксид s SiO2 −911 Диоксид азота g NO2 +33 Монооксид азота g NO +90 Вода l H2O −286 Вода g H2O −241.8 Диоксид углерода g CO2 −393.5 Водород g H2 0 Фтор g F2 0 Хлор g Cl2 0 Бром l Br2 0 Бром g Br2 0 - (Фаза: g — газоообразный; l — жидкий; s — твёрдый; aq = сольватированный)
Инвариантная энтальпия в релятивистской термодинамике
При построении релятивистской термодинамики (с учетом специальной теории относительности) обычно наиболее удобным подходом является использование так называемой инвариантной энтальпии — для системы, находящейся в некотором сосуде.
При этом подходе температура T определяется как лоренц-инвариант. Энтропия S — также инвариант. Поскольку стенки влияют на систему, наиболее естественной независимой переменной является давление P, в связи с чем в качестве термодинамического потенциала удобно брать именно энтальпию.
Для такой системы «обычная» энтальпия и импульс системы
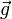 образуют 4-вектор, и за определение инвариантной энтальпии, одинаковой во всех системах отсчёта, берётся инвариантная функция этого 4-вектора:
образуют 4-вектор, и за определение инвариантной энтальпии, одинаковой во всех системах отсчёта, берётся инвариантная функция этого 4-вектора:Основное уравнение релятивистской термодинамики записывается через дифференциал инвариантной энтальпии следующим образом:
Пользуясь этим уравнением, можно решить любой вопрос термодинамики движущихся систем, если известна функция H(S,P,N).
Источники
- Болгарский А. В., Мухачев Г. А., Щукин В. К., «Термодинамика и теплопередача» Изд. 2-е, перераб. и доп. М.: «Высшая школа», 1975, 495 с.
- Харин А. Н., Катаева Н. А., Харина Л. Т., под ред. проф. Харина А. Н. «Курс химии», М.: «Высшая школа», 1975, 416 с.
Wikimedia Foundation. 2010.