- Нитрометан
-
Нитрометан 
Общие Систематическое наименование нитрометан Химическая формула CH3NO2 Эмпирическая формула CH3NO2 Физические свойства Состояние (ст. усл.) бесцветная жидкость Отн. молек. масса 61.04 а. е. м. Молярная масса 61 г/моль Плотность 1,138 г/см³ Динамическая вязкость (ст. усл.) 0.61 мПа·с Па·с
(при 20 °C)Термические свойства Температура плавления -28,5 °C Температура кипения 101,2 °C Температура вспышки 36 °C Энтальпия образования (ст. усл.) -113,1 кДж/моль Удельная теплота испарения 38,28 Дж/кг Удельная теплота плавления 9,7 Дж/кг Давление пара 36,4 гПа (20 °C) Химические свойства pKa 10.2 Растворимость в воде 10.5 г/100 мл Оптические свойства Показатель преломления 1,3817 Структура Дипольный момент 3,50 Д Классификация Рег. номер CAS 75-52-5 RTECS PA9800000 Нитрометан — химическое соединение с формулой СН3NO2, простейший представитель нитросоединений алифатического ряда.
Содержание
Физические свойства
Бесцветная высокополярная жидкость(ε 35.87), имеющая запах горького миндаля; tкип=101,2 °C, tпл=-28,5 °C, плотность 1,138 г/см³ (20 °C); ограниченно растворим в воде — 10,5 г на 100 г воды, и растворяет 1,93 г воды в 100 г нитрометана, смешивается с обычными органическими растворителями; образует азеотропную смесь с водой (76,4 % нитрометана, tкип=83,6 °C) [1] . Не растворяется в предельных углеводородах. Температура горения 4000 °C. Нитрометан горит желтым пламенем.
Химические свойства
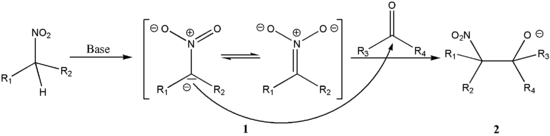
Благодаря наличию нитрогруппы атомы водорода в нитрометане подвижны, могут отщепляться в растворе при действии оснований (pKa = 10,2).
- CH3NO2 + NaOH → CH2=N(O)ONa + H2O
Нитрометан вступает во взаимодействие с кетонами, альдегидами в так называемой нитральдольной реакции или реакции Анри[2],
например с формальдегидом
- СН3NO2 + CH2=О → HOCH2CH2NO2.
При использовании избытка формальдегида замещяются все три атома водорода и образуется три(гидроксиметилен)нитрометан
- СН3NO2 + 3CH2=О → (CH2OH)3CNO2
который при восстановлении образует (CH2OH)3CNH2 — три(гидроксиметилен)метиламин («tris»), основной компонент трис-буфера.
Нитрометан также выступает как донор в реакции Михаэля, присоединясь к α,β-непредельным соединения по схеме 1,4-присоединения.
Взаимодействует с окисью этилена, и др. соединениями.
Получение
В химической промышленности нитрометан обычно получают деструктивным нитрованием низших алканов, например, пропана, 50-70 % азотной кислотой при 400—700 °C. В этом процессе также получается нитроэтан, 1-нитропропан, 2-нитропропан. Смесь разделяется фракционированием.
В лаборатории нитрометан может быть получен по следующей реакции (Г. Кольбе)
- ClCH2COONa + NaNO2 + H2O → CH3NO2 (35-38%) + NaCl + NaHCO3
или реакцией бромметана с нитритом серебра
- CH3Br + AgNO2 → CH3NO2 + AgBr↓
также реакцией диметилсульфата с нитритом натрия
- (CH3)2SO4 + 2NaNO2 → 2 CH3NO2 + Na2SO4
Применение
- Основное применение нитрометана — в качестве растворителя (например, эфироцеллюлозных лаков, виниловых полимеров, цианакрилатов, некоторых красок), для экстрак 8+8+16+ ароматических углеводородов, в производстве хлорпикрина, некоторых взрывчатых веществ.
- В качестве реактивного топлива
- Также используется как добавка к топливу для калильных двигателей внутреннего сгорания (например у радиоуправляемых моделей).
- В качестве топлива для гоночных болидов — «nitro», «Top fuel» (драгстеров).
Содержание кислорода в нитрометане позволяет ему гореть с много меньшим количеством атмосферного воздуха по сравнению с углеводородами бензина:
4CH3NO2 + 3O2 → 4CO2 + 6H2O + 2N2
14,7 кг воздуха необходимо для сжигания килограмма бензина, но только 1,7 кг воздуха на один килограмм нитрометана. Так как цилиндр двигателя может содержать только ограниченное количество воздуха при каждом такте, в 8,7 раз больше нитрометана по сравнению с бензином может быть сожжено в один такт. Нитрометан,однако, имеет меньшую плотность энергии: бензин выделяет около 42–44 МДж/кг в то время как, нитрометан даёт 11,3 МДж/кг. Этот расчёт показывает, что нитрометан производит примерно в 2,3 раза больше мощности по сравнению с обычным топливом.
Нитрометан также может быть использован как монопропеллант, т. е. топливо, способное гореть без добавки кислорода, ниже уравнение этой реакции:
4CH3NO2 → 4CO + 4H2O + 2H2 + 2N2
Нитрометан имеет ламинарную скорость горения 0,5 м/с (немного выше чем у бензина), таким образом делая его пригодным для высокоскоростных двигателей. Кроме того, температура пламени несколько выше — 2400 °C. Высокая удельная теплота парообразования (0,56 МДж/кг) вместе с высокой скоростью течения приводит к сильному охлаждению подходящего топлива (примерно вдвое больше, чем у метанола), в результате получаются довольно низкие температуры.
Нитрометан часто используют в богатых воздушно-топливных смесях, поскольку он даёт энергию даже при отсутствии атмосферного кислорода. При использовании богатой воздушно-топливной смеси, часть продуктов сгорания — водород и монооксид углерода. Эти газы часто воспламеняются, иногда впечатляюще, когда очень богатые смеси ещё горящего топлива покидают выхлопные трубы. Очень богатые смеси необходимы, чтобы снизить температуру камеры сгорания, для управления предварительным зажиганием и последующей детонацией. Рабочие детали зависят от свойства смеси и характеристики двигателя.
Небольшое количество гидразина, смешанное с нитрометаном, может ещё больше увеличить выдаваемую мощность. Гидразин образует с нитрометаном взрывоопасную соль, тоже монопропеллант. Эта нестабильная смесь представляет серьёзную опасность и запрещена к применению в авиамодельном топливе.
В авиамоделизме и автомобильном калильном топливе основной ингредиент обычно метанол, с небольшой добавкой нитрометана (от 0% до 65%, но редко больше 30%, так как нитрометан дороже метанола) и 10–20% смазки (обычно касторовое масло и/или синтетическое масло). Даже умеренные количества нитрометана приводят к увеличении мощности, выдаваемой двигателем (поскольку обычно ограничивающий фактор — приток воздуха), упрощая настройку двигателя (оптимизацию соотношения воздух/топливо).
Взрывчатые свойства
Нитрометан не относили ко взрывчатым веществам до взрыва железнодорожной цистерны 1 июля 1958 года[3]
Очистка
Нитрометан замораживают, образующиеся кристаллы промывают диэтиловым эфиром, затем перегоняют.
Токсичность
Нитрометан ядовит при вдыхании паров или проглатывании поражает печень и почки, центральную нервную систему. Наркотик, обладающий также судорожным действием и последействием.
ЛД50=950 мг/кг для мышей.
ПДК 30 мг/м³
Примечания
Для улучшения этой статьи желательно?: - Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
Категории:- Нитросоединения
- Производные метана
Wikimedia Foundation. 2010.