- Неорганические тиоцианаты
-
Тиоцианаты (тиоцианиды, роданиды, сульфоцианиды) — соли роданистоводородной (тиоциановой) кислоты. Содержат ион SCN−.
Содержание
Физико-химические свойства
Неорганические тиоцианаты являются кристаллическими веществами с высокими температурами плавления. Тиоцианаты щелочных металлов и аммония имеют формулу Me+NCS-, для других тиоцианатов возможна формула Me(SCN)x.
Неорганические тиоцианаты вступают в реакции окисления, восстановления, галогенирования и обмена:
Кроме того, тиоцианаты могут образовывать комплексные соединения. В них лиганд - тиоцианат-ион - может координироваться как атомом азота, так и атомом серы, например, тетрароданоферрат калия: K[Fe(SCN)4]. Реакция образования окрашенного в кроваво-красный цвет тетрароданоферрата калия служит в аналитической химии качественной реакцией на ион Fe3+.
При термической изомеризации тиоцианата аммония образуется тиомочевина:
Получение и применение
Тиоцианаты получают реакцией элементарной серы или полисульфидов с цианидами. Эти реакции позволяют перевести токсичный цианид-ион в гораздо менее опасный тиоцианат-ион:
В промышленности тиоцианаты щелочных металлов получают взаимодействием растворов соответствующих полисульфидов с коксовым газом, содержащим примеси цианидов; тиоцианат аммония — по реакции аммиака с сероуглеродом.
В аналитической химии применяются как реактив на ионы трёхвалентного железа, с которым образуют кроваво-красные тиоцианатные комплексы Fe(III), а также для фотометрического определения некоторых металлов (например, кобальта, железа, висмута, молибдена, вольфрама, рения).
Тиоцианаты применяются в производстве тиомочевины, являются реагентами в процессах крашения и печатании тканей, в аналитической химии (качественный и количественный анализ), как ядохимикаты (инсектициды и фунгициды), стабилизаторы горения взрывчатых веществ, в процессах выделения и разделения редких металлов, для получения органических тиоцианатов. Тиоцианаты ниобия(V) и тантала(V) служат в качестве катализаторов реакции Фриделя-Крафтса.
Биологическая роль
Тиоцианаты сравнительно малотоксичны (например, ЛД50 для NaNCS составляет 370 мг/кг) , однако способны раздражать кожу, поражать щитовидную железу, почки и вызывать ксантопсию. Токсичность тиоцианатов тяжёлых металлов в основном определяются ядовитостью ионов металлов, а не тиоцианат-иона.
Тиоцианаты найдены в живых организмах: в слюне и желудочном соке животных, соке лука Allium coepa.
Литература
- Зефиров Н.С. и др. т.4 Пол-Три // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1995. — 639 с. — 20 000 экз. — ISBN 5-85270-092-4
 Категория:
Категория:- Тиоцианаты
-
Wikimedia Foundation. 2010.

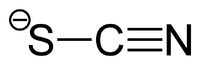


![\mathsf{KNCS + Zn + HBr \rightarrow [CH_3NH_3]Cl + KCl + ZnCl_2}](b37f8748e0fb969a0932bf6ed97fb184.png)


![\mathsf{NH_4NCS \xrightarrow[]{180^oC} (NH_2)_2CS}](843c0475f39799dccc25aa1b16a57315.png)

