- Стибин
-
Стибин 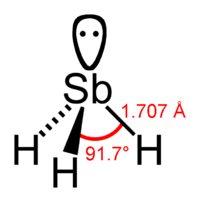

Общие Систематическое наименование стибин (англ. Stibane) Традиционные названия сурьмянистый водород, антимонид водорода Химическая формула H3Sb Физические свойства Состояние (ст. усл.) бесцветный легковоспламеняющийся газ, жидкость Молярная масса 124.784 г/моль Плотность 5.48 г/см³ Термические свойства Температура плавления −88 °C Температура кипения −17 °C Молярная теплоёмкость (ст. усл.) 41 Дж/(моль·К) Давление пара 82,8 кПа Химические свойства Растворимость в воде слабо растворим Растворимость в остальных веществах растворим в этаноле и сероуглероде Структура Координационная геометрия тригональная, пирамидальная Классификация Рег. номер CAS 7803-52-3 Безопасность ЛД50 100 мг/кг Токсичность Стибин (сурьмянистый водород) — неорганическое бинарное химическое соединение сурьмы с водородом, имеющее запах сероводорода (то есть запах тухлых яиц). Химическая формула
 .
.Содержание
История получения/изучения
Стибин очень похож на арсин — это было обнаружено с помощью пробы Марша. Это тест определяет количество арсина, получаемое в присутствии мышьяка. Процедура разработана около 1836 года Джеймсом Маршем. Газ заметен в стеклянной трубке и разлагается посредством нагрева до температуры 250—300 °C. Присутствие мышьяка было указано по образованию осадка в нагретой части. Образование черного налета на стекле в прохладной части оборудования указывает на присутствие сурьмы.
В 1837 году Льюис Томсон и Пфафф независимо обнаружили стибин. Потребовалось некоторое время, прежде чем свойства токсичных газов могли были определены, это отчасти объяснялось тем, что подходящих для постепенного синтеза приборов еще не было. В 1876 году Фрэнсис Джонс протестировал несколько методов синтеза, но затем в 1901 году Альфредом Стоком было определено большинство свойств стибина.
Свойства
Физические
- Стандартная энергия Гиббса
 составляет 148 кДж/моль
составляет 148 кДж/моль - Стандартная энтропия образования
 составляет 233 Дж/(моль·K)
составляет 233 Дж/(моль·K)
Химические
Бесцветный легковоспламеняющийся газ с неприятным запахом. Сильный восстановитель, ядовит.
Химические свойства H3Sb схожи с арсином. Типичная для тяжелых соединений с водородом (например, AsH3, H2Te, автокатализа, которое может быть взрывоопасным:
Стибин легко окисляется кислородом O2 или даже воздухом:
Стибин может быть депротонирован. В данном случае выделяется аммиак и дигидросурьмид натрия:
Получение
Получают действием атомарного водорода на соединения сурьмы или при действии кислот на антимониды магния, цинка. Или, как правило, последовательной реакцией катиона Sb3+ с анионом H− и образуется Sb3− и H+
Кроме того, соединения с Sb3− реагируют с протонными реагентами (даже с водой), давая стибин в виде нестабильного газа:
- NaOH.
Синтез
Получается при воздействии на гидроксид сурьмы(III) водородом:
Так же существует возможность реакции антимонида магния в избытке разбавленной соляной кислоты. Получается стибин и хлорид магния:
Оба метода получение, имеют недостаток, заключающейся в том, что в результате газообразный стибин состоит в смеси с водородом. При охлаждении газа до уровня ниже −17 °C этот недостаток может быть устранен, потому что стибин конденсируется при такой температуре.
Методом, который позволяет не получить такой недостаток, является гидрирование хлорида сурьмы(III) с использованием борогидрида натрия в растворе соляной кислоты:
Применение
Стибин используется в полупроводниковой промышленности с добавкой небольших количеств сурьмы с использованием процесса химического осаждения паров (ССЗ). Так же сообщается, что стибин используется как фумигант, но его нестабильность и быстрая выветриваемость контрастирует с более традиционным фумигантом PH3.
Опасность применения
Он высоко токсичен: ЛД50 от 100 мг/кг у мышей. К счастью, стибин настолько неустойчив, что он редко встречается за пределами лабораторий.
Токсикологические свойства
Стибин отличается по токсичности от других соединений сурьмы, но аналогичен арсину. Стибин связывается с гемоглобином красных кровяных клеток, заставляя их разрушаться. В большинстве случаев отравления стибина не схоже с арсиновым, хотя исследования на животных показывают, что их токсичность эквивалентна. Первые признаки воздействия, которое могут появиться через несколько часов очевидны:
- головные боли,
- головокружение и тошнота, а затем симптомы гемолитической анемии (высокий уровень неконъюгированного билирубина),
- гемоглобинурия,
- нефропатия.
См. также
Соединения сурьмыАнтимонид галлия (GaSb) • Антимонид индия (InSb) • Антимониды • Бромид сурьмы(III) (SbBr3) • Гексагидроксостибат калия (K[Sb(OH)6]) • Гексахлоростибат водорода (H[SbCl6]•4,5H2O) • Гексафтороантимонат водорода (H[SbF6]) • Гексафторостибат натрия (Na[SbF6]) • Иодид сурьмы(III) (SbI3) • Иодид сурьмы(V) (SbI5) • Оксид сурьмы(III) (Sb2O3) • Оксид сурьмы(V) (Sb2O5) • Оксибромид сурьмы (Sb4O5Br2) • Оксид-хлорид сурьмы (SbOCl) • Оксихлорид сурьмы (Sb4O5Cl2) • Оксистибат ртути (Hg2Sb2O7) • Селенид сурьмы(III) (Sb2Se3) • Соль Шлиппе (Na3[SbS4]·9H2O) • Стибин (H3Sb) • Сульфат сурьмы (Sb2(SO4)3) • Сульфид сурьмы(III) (Sb2S3) • Сульфид сурьмы(V) (Sb2S5) • Сурьмяная кислота • Теллурид сурьмы(III) (Sb2Te3) • Тетраоксид сурьмы (Sb2O4) • Триметилсурьма (Sb(CH3)3) • Трифенилсурьма (Sb(C6H5)3) • Триэтилсурьма (Sb(C2H5)3) • Тритиостибат натрия (Na3[SbS3]) • Фторид сурьмы(III) (SbF3) • Фторид сурьмы(V) (SbF5) • Хлорид сурьмы(III) (SbCl3) • Хлорид сурьмы(V) (SbCl5) •
АнтимонидыАнтимонид алюминия (AlSb) • Антимонид цинка(III) (ZnSb) • Антимонид галлия (GaSb) • Антимонид индия (InSb) • Антимонид кадмия (CdSb) • Антимонид цезия (Cs3Sb) • Антимонид никеля (NiSb) • Антимонид тория (Th3Sb4) • Антимонид хрома (CrSb) • Антимонид кобальта (CoSb) • Антимонид магния (Mg3Sb2) • Стибин (H3Sb) • Антимонид урана (USb) • Антимонид марганца (MnSb) • Антимонид серебра (Ag3Sb) • Антимонид иттрия(III) (YSb) • Ауростибит (AuSb2) • Антимонид ртути (Hg3Sb2) • Антимонид олова (SnSb) • Антимонид молибдена (Mo3Sb7) • Антимонид вольфрама (WSb) • Антимонид осмия (OsSb2) • Антимонид меди (Cu2Sb) • Антимонид ниобия (Nb5Sb4) • Антимонид титана (Ti3Sb) • Антимонид цинка(II) (Zn3Sb2) • Антимонид кальция(II) (Ca3Sb2) • Антимонид натрия (Na3Sb) • Антимонид таллия (Tl7Sb2)
Категории:- Соединения сурьмы
- Антимониды
- Высокоопасные вещества
- Бинарные соединения
- Гидриды
- Стандартная энергия Гиббса
Wikimedia Foundation. 2010.









