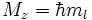- Электронная орбиталь
-
Атомная орбиталь — одноэлектронная волновая функция в сферически симметричном электрическом поле атомного ядра, задающаяся главным n, орбитальным l и магнитным m квантовыми числами.
Название «орбиталь» (а не орбита) отражает геометрическое представление о движении электрона в атоме; такое особое название отражает тот факт, что движение электрона в атоме описывается законами квантовой механики и отличается от классического движения по траектории. Совокупность атомных орбиталей с одинаковым значением главного квантового числа n составляют одну электронную оболочку.
Содержание
Квантовые числа и номенклатура орбиталей
 Радиальное распределение плотности вероятности для атомных орбиталей при различных n и l.
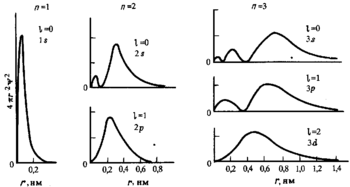
Радиальное распределение плотности вероятности для атомных орбиталей при различных n и l.- Главное квантовое число n может принимать любые целые положительные значения, начиная с единицы (n = 1,2,3, … ∞) и определяет общую энергию электрона на данной орбитали (энергетический уровень) :
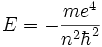
- Энергия для n = ∞ соответствует энергии одноэлектронной ионизации для данного энергетического уровня.
- Орбитальное квантовое число (называемое также азимутальным или дополнительным квантовым числом) определяет момент импульса электрона и может принимать целые значения от 0 до n - 1 (l = 0,1, …, n - 1). Момент импульса при этом задается соотношением
- Атомные орбитали принято называть по буквенному обозначению их орбитального числа:
Значение орбитального квантового числа 0 1 2 3 4 Буквенное обозначение s p d f g - Магнитное квантовое число ml определяет проекцию орбитального момента импульса на направление магнитного поля и может принимать целые значения в диапазоне от -l до l, включая 0 (ml = -l … 0 … l):
В литературе орбитали обозначают комбинацией квантовых чисел, при этом главное квантовое число обозначают цифрой, орбитальное квантовое число - соответствующей буквой (см. таблицу ниже) и магнитное квантовое число - выражением в нижеем индексе, показывающем проекцию орбитали на декартовы оси x, y, z, например 2px, 3dxy, 4fz(x2-y2). Для орбиталей внешней электронной оболочки, то есть в случае описания валентных электронов, главное квантовое число в записи орбитали, как правило, опускают.
Геометрическое представление
Геометрическое представление атомной орбитали - область пространства, ограниченная поверхностью равной плотности (эквиденситной поверхностью) вероятности или заряда. Плотность вероятности на граничной поверхности выбирают исходя из решаемой задачи, но, обычно, таким образом, чтобы вероятность нахождения электрона в ограниченной области лежит в диапазоне значений 0.9-0.99.
Поскольку энергия электрона определяется кулоновским взаимодействием и, следовательно, расстоянием от ядра, то главное квантовое число n задает размер орбитали.
Форма и симметрия орбитали задаются орбитальным квантовыми числами l и m: s-орбитали являются сферически симметричными, p, d и f-орбитали имеют более сложную форму, определяемую угловыми частями волновой функции - угловыми функциями. Угловые функции Ylm (φ , θ) - собственные функции оператора квадрата углового момента L2, зависящие от квантовых чисел l и m, являются комплексными и описывают в сферических координатах (φ , θ) угловую зависимость вероятности нахождения электрона в центральном поле атома. Линейная комбинация этих функций определяет положение орбиталей относительно декартовых осей координат.
Для линейных комбинаций Ylm приняты следующие обозначения:
Значение орбитального квантового числа 0 1 1 1 2 2 2 2 2 Значение магнитного квантового числа 0 0 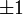
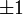
0 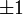
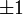
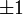
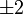
Линейная комбинация - - 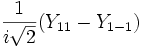
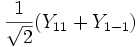
- 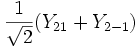
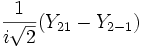
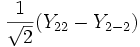
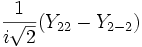
Обозначение 
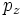
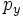
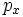
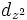
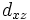
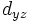
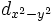
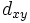
Дополнительным фактором, иногда учитываемым в геометрическом представлении, является знак волновой функции (фаза). Этот фактор существеннен для орбиталей с орбитальным квантовым числом l, отличным от нуля, то есть не обладающих сферической симметрией: знак волновой функции их "лепестков", лежащих по разные стороны узловой плоскости, противоположен. Знак волновой функции учитывается в методе молекулярных орбиталей МО ЛКАО (молекулярные орбитали как линейная комбинация атомных орбиталей).
Заполнение орбиталей электронами и электронная конфигурация атома
На каждой орбитали может быть не более двух электронов, отличающихся значением спинового квантового числа s (спина). Этот запрет определён принципом Паули. Порядок заполнения электронами орбиталей одного уровня (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется Правилом Хунда.
Краткую запись распределения электронов в атоме по различным электронным оболочкам атома с учётом их главного и орбитального квантовых чисел n и l называют электронной конфигурацией атома.
См. также
- Квантовые числа
- Строение атома
- Модели орбиталей
Ссылки
Wikimedia Foundation. 2010.