- Хромат бария
-
Хромат бария 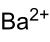
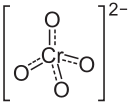
Общие Систематическое наименование Хромат бария Химическая формула BaCrO4 Физические свойства Состояние (ст. усл.) твердый Отн. молек. масса 253,37 а. е. м. Молярная масса 253,37 г/моль Плотность 4,5 г/см³ Термические свойства Температура плавления 1380 °C Энтальпия образования (ст. усл.) -1366,8 кДж/моль Химические свойства Растворимость в воде (при 20 °C) 0,00028 г/100 мл Классификация Рег. номер CAS 10294-40-3 SMILES [Ba+2].[O-][Cr]([O-])(=O)=O RTECS CQ876000 Безопасность Токсичность Хромат (VI) бария — бариевая соль хромовой кислоты, имеющая химическую формулу BaCrO4.
Содержание
Физические и химические свойства
Хромат бария представляет собой ярко-желтое кристаллическое вещество плохо растворимое в воде (ПР=2,4·10−10[1]). Низкая растворимость этого соединения используется в аналитической практике для отделения и определения солей бария.
В растворах сильных неорганических кислот растворяется с образованием бихромата:
Плохо растворим в уксусной кислоте, что используется для отделения бария от ионов стронция [1].
При прокаливании в смеси с Ba(OH)2 и присутствии азида натрия превращается в хромат(V) бария. При этом выделяется кислород и вода:
Получение
Взаимодействием растворов Ba(OH)2 или BaS с хроматом натрия или калия:

Токсичность
Хромат бария — ядовит, особенно при попадании внутрь организма человека вследствие его перехода под действием кислоты желудка в растворимую форму. ПДК 0,01 мг/м³ (в пересчете на CrO3).
Применение
- Пигмент («баритовый желтый») для керамики, фарфора, красок.
- Входит в состав некоторых пиротехнических композиций.
- Компонент безопасных спичек.
- Ингибитор коррозии.
- Для изготовления воспламеняющих составов.
- Один из возможных реагентов для осаждения радия из кислых урановых растворов[2].
Примечания
Соединения барияАмид бария (Ba(NH2)2) • Ацетат бария (Ba(CH3COO)2) • Бромид бария (BaBr2) • Гидрид бария (BaH2) • Гидроксид бария (Ba(OH)2) • Гидросульфид бария (Ba(HS)2) • Дитионат бария (BaS2O6) • Иодат бария (Ba(IO3)2) • Иодид бария (BaI2) • Карбид бария (BaC2) • Карбонат бария (BaCO3) • Манганат бария (BaMnO4) • Метаборат бария (Ba(BO2)2) • Нитрат бария (Ba(NO3)2) • Нитрид бария (Ba3N2) • Нитрит бария (Ba(NO2)2) • Оксалат бария (BaC2O4) • Оксид бария (BaO) • Пероксид бария (BaO2) • Перхлорат бария (BaClO4) • Силикат бария (ВаSiO3) • Сульфат бария (BaSO4) • Сульфид бария (BaS) • Сульфит бария (BaSO3) • Титанат бария (BaTiO3) • Феррат бария (BaFeO4) • Феррит бария (BaFe2O4) • Фосфат бария (Ba3(PO4)2) • Фосфид бария (Ba3P2) • Фторид бария (BaF2) • Хлорат бария (Ba(ClO3)2) • Хлорид бария (BaCl2) • Хромат бария (BaCrO4) • Хромат(V) бария (Ba3(CrO4)2) • Цианид бария (Ba(CN)2) • Цирконат бария (BaZrO3)
ХроматыХромат бария (BaCrO4) • Хромат цезия (Cs2CrO4) • Хромат кальция (CaCrO4) • Хромат(II) калия (К2СrO4) • Хромат меди (СuСrO4) • Хромат серебра (Ag2CrO4) • Хромат стронция (SrCrO4) • Хромат цинка (ZnCrO4) • Хромат свинца(II) (РbСrO4) • Хромат аммония ((NН4)2СrO4)
Категории:- Соединения бария
- Хроматы
- Пигменты
- Соединения хрома
- Соединения кислорода
Wikimedia Foundation. 2010.



