- Фторид кислорода
-
Фторид кислорода(II) 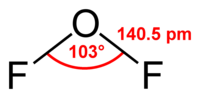
Общие Систематическое наименование Фторид кислорода (II) Химическая формула OF2 Отн. молек. масса 54 а. е. м. Физические свойства Плотность вещества 1,59 г/см³ Состояние (ст. усл.) бледно-жёлтый газ Термические свойства Температура плавления -224 °C Температура кипения -145 °C Температура разложения выше 200 °C Критическая точка -58°C, 49 атм Энтальпия (ст. усл.) -25,2 кДж/моль Классификация номер CAS 7783-41-7 Фторид кислорода(II), дифторид кислорода, OF2. Представляет собой бесцветный газ, конденсирующийся при охлаждении в светло-желтую (в толстых слоях золотисто-желтую) жидкость. Фторид кислорода(II) имеет раздражающий запах несколько отличающийся от запаха фтора (смесь запаха хлорной извести и озона).
Содержание
Открытие
Дифторид кислорода был открыт впервые в 1927 году Лебо и Дамьеном, а спустя некоторое время подробно изучен Руффом и Менцелем.
Систематическое название
В литературе иногда это соединение называют оксидом фтора (F2O). Однако, это неверно, так как атом фтора более электроотрицателен чем кислород, и по правилам IUPAC это соединение должно называться именно фторид кислорода (OF2).
Физические свойства
Жидкий фторид кислорода неограниченно смешивается с жидкими озоном, фтором, кислородом. Плохо растворяется в холодной воде (примерно 7:100 по объёму). При этом достаточно хорошо растворяет воздух.
Молекула обладает слабым дипольным моментом, равным 0,3 Дб
Получение
- Получение фторида кислорода(II) до сих пор проводят по так называемому «щелочному» способу пропусканием газообразного фтора в 2% (0,5 нормальный) водный раствор гидроксида натрия (NaOH). Помимо фторида кислорода(II) в реакции происходит образование перекиси водорода, и озона:
- 2F2 + 2NaOH = OF2 + 2NaF + H2O
- Возможно также получение фторида кислорода(II) электролизом водного раствора HF.
- При горении воды в атмосфере фтора также частично образуется дифторид кислорода и пероксид водорода. Это происходит за счёт протекания радикальных реакций:
- F2 + H2O → 2HF + O· — инициация свободных радикалов
- 2O· → O2 — доминирующий процесс
- O· + H2O → H2O2
- O· + F2 → F2O
Химические свойства
Дифторид кислорода весьма энергичный окислитель, и в этом отношении напоминает фтор, но реакции с участием фторида кислорода(II) требуют более высокой энергии активации, поскольку на первой стадии происходит образование атомарного кислорода. Термическое разложение фторида кислорода(II) представляет собой мономолекулярную реакцию с энергией активации 41 ккал/моль и начинается только при температуре выше 200°C.
При растворении в горячей воде, подвергается гидролизу. В щелочной среде разложение протекает достаточно быстро.
Смесь паров дифторида кислорода и воды взрывоопасна:
- OF2 + H2O → 2HF + O2
Фторид кислорода(II) не действует на сухое стекло и кварц, но действует (интенсивно) на металлическую ртуть — что исключает применение ртути в приборах с фторидом кислорода(II). На смазку для газовых кранов фторид кислорода(II) действует очень медленно.
Взаимодействие с металлами
На меди, платине, золоте, серебре, фторид кислорода(II) образует лишь тончайшие защитные пленки фторидов, что позволяет использовать эти металлы в контакте с фторидом кислорода(II) при комнатной температуре. При повышении температур до 250°C проиходит дальнейшее окисление металлов. Наиболее подходящими металлами для работы с дифторидом кислорода являются алюминий и магний. Нержавеющие стали, никель, монель-металл, магниевомедный сплав (92/8), латунь и медь, также мало изменяются в весе при воздействии фторида кислорода(II) в течение 1-1,5 недели при 100 °C.
Применение
Благодаря высокой энергии активации разложения фторида кислорода(II), последнюю можно сравнительно безопасно смешивать с многими углеводородами, водородом, моноокисью углерода и прочими веществами, что чрезвычайно важно в практическом плане использования фторида кислорода(II) в качестве высокоэффективного окислителя ракетного топлива. Так как фторид кислорода(II) не взрывается при смешивании с горючими материалами и при нагревании (сам по себе) то ее применение вполне безопасно.
Имели значительный успех опыты применения фторида кислорода(II) в газодинамических химических лазерах. Имея лучшие показателе нежели фтор, фторид кислорода(II) способен занять достойное место в качестве компонента для боевого лазерного оружия высокой мощности.
Токсичность
Фторид кислорода(II) весьма токсичен и по силе превышает фосген, с другой стороны он гораздо ядовитей чем фтор, так как вызывает сильнейшее раздражение тканей организма, очень глубоко проникает и растворяется в них (глубже чем фтор), затрудняет дыхание.
Упоминания в литературе
В фантастической новелле Роберта Л. Форварда «Камелот 30К», дифторид кислорода был использован как биохимический растворитель для живых форм Солнечой системы
Ссылки
См. также
Литература
- С.Сарнер. Химия ракетных топлив. изд «Мир», Москва, 1969.г.
- Schmidt E. W.,Harper J. T., Handling and Use of Fluoride and Fluorine-Oxygen Mixtures in Rocket Systems, Lewis Research Center, NASA SP-3037, Cleveland, Ohio, 1967.
Wikimedia Foundation. 2010.
