- Меланж (химия)
-
Азотная кислота 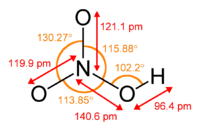
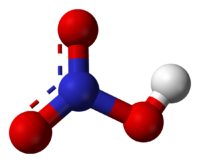
Общие Систематическое наименование азотная кислота Химическая формула HNO3 Отн. молек. масса 63.012 а. е. м. Молярная масса 63.012 г/моль Физические свойства Плотность вещества 1.51 г/см³ Состояние (ст. усл.) жидкое Термические свойства Температура плавления -42 °C Температура кипения 83 °C Химические свойства pKa -1.4 Растворимость в воде смешивается г/100 мл Классификация номер CAS 7697-37-2 — HNO3, кислородосодержащая, одноосновная, сильная кислота. Твердая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решетками. Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентраций 68,4 % и tкип120 °C при 1 атм. Известны два твердых гидрата: моногидрат(HNO3·H2O) и тригидрат (HNO3·3H2O).
Плотность азотной кислоты в водных растворах 10 % 1,0543 г/мл 20 % 1,1150 г/мл 50 % 1,3100 г/мл 70 % 1,4134 г/мл 90 % 1,4826 г/мл Содержание
Свойства
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
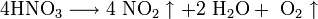
Так же распадается HNO3 и при нагревании. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении (указанная выше т. кип. при атмосферном давлении найдена экстраполяцией).
Азотная кислота является сильным окислителем, концентрированная азотная кислота окисляет серу до серной, а фосфор — до фосфорной кислот, некоторые органические соединения (например амины и гидразины, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Золото, некоторые металлы платиновой группы и тантал инертны по отношению к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её условиями. Так, концентрированная азотная кислота реагирует с медью с образованием диоксида азота, а разбавленная — оксида азота (II):
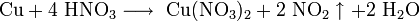
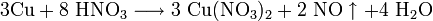
Большинство металлов реагируют с азотной кислотой с выделением оксидов азота в различных степенях окисления или их смесей, разбавленная азотная кислота при реакции с активными металлами может реагировать с выделением водорода и восстановлением нитрат-иона до аммиака.
Некоторые металлы (железо, хром, алюминий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж».Азотная кислота широко используется для получения нитросоединений.
Смесь трех объемов соляной кислотой и одного объема азотной называется «царской водкой», которая растворяет большинство металлов, в том числе и золото. Ее сильные окислительные способности обусловлены образующимся хлором:
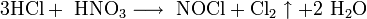
Нитраты
HNO3 — сильная кислота. Ее соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Их растворы обладают незначительными окислительными свойствами.
При нагревании нитраты разлагаются, нитраты щелочных металлов превращаются в нитриты:
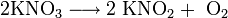
Соли других металлов образуют оксиды:
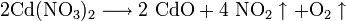
При разложении нитратов металлов, оксиды которых нестабильны, выделяется свободный металл:
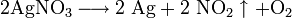
Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
![\mathrm{3KNO_3 + 8 \ Al + 5 \ KOH + 18 \ H_2O \longrightarrow 3 \ NH_3 \uparrow + 8 \ K[Al(OH)_4]}](/pictures/wiki/files/101/e446cb1fe8d9af4671d5b632b313cac0.png)
Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде. Поэтому в виде минералов их природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно.
С азотной кислотой не реагируют стекло, фторопласт-4.
Исторические сведения
Методика получения разбавленной азотной кислоты путём сухой перегонки селитры с квасцами и медным купоросом была, по видимому, впервые описана трактатах Джабира (Гебера в латинизированных переводах) в VIII веке. Этот метод с теми или иными модификациями, наиболее существенной из которых была замена медного купороса железным, применялся в европейской и арабской алхимии вплоть до XVII века.
В XVII веке Глаубер предложил метод получения летучих кислот реакцией их солей с концентрированной серной кислотой, в том числе и азотной кислоты из калийной селитры, что позволило ввести в химическую практику концентрированную азотную кислоту и изучить её свойства. Метод Глаубера применялся до начала XX века, причём единственной существенной модификацией его оказалась замена калийной селитры на более дешёвую натриевую (чилийскую) селитру.
Промышленное производство и применение
Азотная кислота является одним из самых крупнотоннажных продуктов химической промышленности.
Производство азотной кислоты
Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (метод Габера) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой
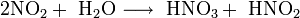
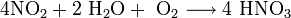
Концентрация полученной таким методом азотной кислоты колеблется, в зависимости от технологического оформления процесса от 45 до 58 %.
Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды.
Применение
- в производстве минеральных удобрений;
- в военной промышленности;
- в фотографии — подкисление некоторых тонирующих растворов[1];
Литература
- Энциклопедический словарь юного химика, Сост. В. А. Крицман, В. В. Станцо. — 2-е издание, М. 1990.
- Ахметов Н. С. «Общая и неорганическая химия» М.:Высшая школа, 2001
Примечания
- ↑ Азотная кислота // Фотокинотехника: Энциклопедия / Главный редактор Е. А. Иофис. — М.: Советская энциклопедия, 1981.
Ссылки
Wikimedia Foundation. 2010.
Полезное
Смотреть что такое "Меланж (химия)" в других словарях:
Азотная кислота — Эта статья включает описание термина «Меланж»; см. также другие значения. Азотная кислота … Википедия
Крепкая водка — Азотная кислота Общие Систематическое наименование азотная кислота Химическая формула … Википедия
История кофе — Кофейные зерна История кофе охватывает несколько периодов. История кофе берёт начало с древнейших времен и уходит корнями в первые цивилизации Ближнего Востока, хотя происхождение кофе до сих пор остаётся неясны … Википедия
Азотнокислые окислители — Азотнокислые окислители категория компонентов долгохранимого жидкого ракетного топлива, используемых в качестве окислителя, основным компонентом которых является азотная кислота. Применяются в боевых ракетах, космических ракетах носителях и … Википедия
