- железо
- ЖЕЛЕ́ЗО -а; ср.1. Химический элемент (Fe), ковкий металл серебристого цвета, образующий в соединении с углеродом сталь и чугун.2. Обиходное название малоуглеродистой стали, металла серебристого цвета. Ковать ж. Ветер стучит железом крыши.3. О том, что является сильным, твёрдым, крепким (о внешних физических качествах). Руки у тебя - ж.! // О том, что является жёстким, непреклонным (о внутренних моральных качествах). Характер у него - ж.4. Разг. О лекарстве, содержащем железистые вещества. Организму не хватает железа. Пить ж. Яблоки содержат ж.5. Разг. техн. Аппаратные средства компьютера (в отличие от программных средств). Купить недостающее железо.◊ Выжечь калёным желе́зом. Искоренять, уничтожать что-л., прибегая к крайним, чрезвычайным мерам. Куй желе́зо, пока горячо (см. Кова́ть).◁ Желе́зный; Желе́зистый; Желе́зка; Желе́зина (см.).* * *желе́зо(лат. Ferrum), химический элемент VIII группы периодической системы. Блестящий серебристо-белый металл. Образует полиморфные модификации; при обычной температуре устойчиво α-Fe (кристаллическая решётка — кубическая объёмно-центрированная) с плотностью 7,874 г/см3. α-Fe вплоть до 769°C (точка Кюри) ферромагнитно; tпл 1535°C. На воздухе окисляется — покрывается рыхлой ржавчиной. По распространённости элементов в природе железо находится на 4-м месте; образует около 300 минералов. На долю сплавов железа с углеродом и другими элементами приходится около 95% всей металлической продукции (чугун, сталь, ферросплавы). В чистом виде практически не используется (в быту железными часто называют стальные или чугунные изделия). Необходимо для жизнедеятельности животных организмов; входит в состав гемоглобина.
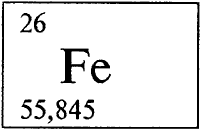 * * *ЖЕЛЕЗОЖЕЛЕ́ЗО (лат. Ferrum), Fe (читается «феррум»), химический элемент, атомный номер 26, атомная масса 55,847. Происхождение как латинского, так и русского названий элемента однозначно не установлено. Природное железо представляет собой смесь четырех нуклидов (см. НУКЛИД) с массовыми числами 54 (содержание в природной смеси 5,82% по массе), 56 (91,66%), 57 (2,19%) и 58 (0,33%). Конфигурация двух внешних электронных слоев 3s2p6d64s2. Обычно образует соединения в степенях окисления +3 (валентность III) и +2 (валентность II). Известны также соединения с атомами железа в степенях окисления +4, +6 и некоторых других.
* * *ЖЕЛЕЗОЖЕЛЕ́ЗО (лат. Ferrum), Fe (читается «феррум»), химический элемент, атомный номер 26, атомная масса 55,847. Происхождение как латинского, так и русского названий элемента однозначно не установлено. Природное железо представляет собой смесь четырех нуклидов (см. НУКЛИД) с массовыми числами 54 (содержание в природной смеси 5,82% по массе), 56 (91,66%), 57 (2,19%) и 58 (0,33%). Конфигурация двух внешних электронных слоев 3s2p6d64s2. Обычно образует соединения в степенях окисления +3 (валентность III) и +2 (валентность II). Известны также соединения с атомами железа в степенях окисления +4, +6 и некоторых других.
В периодической системе Менделеева железо входит в группу VIIIВ. В четвертом периоде, к которому принадлежит и железо, в эту группу входят также кобальт (см. КОБАЛЬТ) и никель (см. НИКЕЛЬ). Эти три элемента образуют триаду и обладают сходными свойствами.
Радиус нейтрального атома железа 0,126 нм, радиус иона Fe2+ — 0,080 нм, иона Fe3+ — 0,067 нм. Энергии последовательной ионизации атома железа 7,893, 16,18, 30,65, 57, 79 эВ. Сродство к электрону 0,58 эв. По шкале Полинга электроотрицательность железа около 1,8.
Железо высокой чистоты — это блестящий серебристо-серый, пластичный металл, хорошо поддающийся различным способам механической обработки.
Нахождение в природе
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красные железняки (руда гематит (см. ГЕМАТИТ), Fe2O3; содержит до 70% Fe), магнитные железняки (руда магнетит (см. МАГНЕТИТ), Fe3О4; содержит 72,4% Fe), бурые железняки (руда гидрогетит НFeO2·nH2O), а также шпатовые железняки (руда сидерит (см. СИДЕРИТ), карбонат железа, FeСО3; содержит около 48% Fe). В природе встречаются также большие месторождения пирита (см. ПИРИТ) FeS2 (другие названия — серный колчедан, железный колчедан, дисульфид железа и другие), но руды с высоким содержанием серы пока практического значения не имеют. По запасам железных руд Россия занимает первое место в мире. В морской воде 1·10-5—1·10-8% железа.
История получения железа
Железо играло и играет исключительную роль в материальной истории человечества. Первое металлическое железо, попавшее в руки человека, имело, вероятно, метеоритное происхождение. Руды железа широко распространены и часто встречаются даже на поверхности Земли, но самородное железо на поверхности крайне редко. Вероятно, еще несколько тысяч лет назад человек заметил, что после горения костра в некоторых случаях наблюдается образование железа из тех кусков руды, которые случайно оказались в костре. При горении костра восстановление железа из руды происходит за счет реакции руды как непосредственно с углем, так и с образующимся при горении оксидом углерода (II) СО. Возможность получения железа из руд существенно облегчило обнаружение того факта, что при нагревании руды с углем возникает металл, который далее можно дополнительно очистить при ковке. Получение железа из руды с помощью сыродутного процесса было изобретено в Западной Азии во 2-м тыс. до н. э. Период с 9 по 7 в. до н. э., когда у многих племен Европы и Азии развилась металлургия железа, получил название железного века, (см. ЖЕЛЕЗНЫЙ ВЕК) пришедшего на смену бронзовому веку (см. БРОНЗОВЫЙ ВЕК). Усовершенствование способов дутья (естественную тягу сменили меха) и увеличение высоты горна (появились низкошахтные печи — домницы) привело к получению чугуна, который стали широко выплавлять в Западной Европе с 14 века. Полученный чугун переделывали в сталь. С середины 18 века в доменном процессе вместо древесного угля начали использовать каменно-угольный кокс (см. КОКС). В дальнейшем способы получения железа из руд были значительно усовершенствованы, и в настоящее время для этого используют специальные устройства — домны, кислородные конвертеры, электродуговые печи.
Физические и химические свойства
При температурах от комнатной и до 917 °C, а также в интервале температур 1394—1535 °C существует a-Fe с кубической объемно центрированной решеткой, при комнатной температуре параметр решетки а = 0,286645 нм. При температурах 917—1394 °C устойчиво b-Fe с кубической гранецентрированной решеткой Т (а = 0,36468 нм). При температурах от комнатной до 769 °C (так называемая точка Кюри (см. КЮРИ ТОЧКА)) железо обладает сильными магнитными свойствами (оно, как говорят, ферромагнитно), при более высоких температурах железо ведет себя как парамагнетик. Иногда парамагнитное a-Fe с кубической объемно центрированной решеткой, устойчивое при температурах от 769 до 917 °C, рассматривают как g-модификацию железа, а b-Fe, устойчивое при высоких температурах (1394—1535 °C), называют по традиции d-Fe (представления о существовании четырех модификаций железа — a, b, g и d— возникли тогда, когда еще не существовал рентгеноструктурный анализ и не было объективной информации о внутреннем строении железа). Температура плавления 1535 °C, температура кипения 2750 °C, плотность 7,87 г/см3. Стандартный потенциал пары Fe2+/Fe0 –0,447В, пары Fe3+/Fe2+ +0,771В.
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной пленкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближенно ее химическую формулу можно записать как Fe2О3·хН2О.
С кислородом железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe2О3, при сгорании в чистом кислороде — оксид Fe3О4. Если кислород или воздух пропускать через расплавленное железо, то образуется оксид FeО. При нагревании порошка серы и железа образуется сульфид, приближенную формулу которого можно записать как FeS.
Железо при нагревании реагирует с галогенами (см. ГАЛОГЕНЫ). Так как FeF3 нелетуч, железо устойчиво к действию фтора до температуры 200—300°C. При хлорировании железа (при температуре около 200°C) образуется летучий FeСl3. Если взаимодействие железа и брома протекает при комнатной температуре или при нагревании и повышенном давлении паров брома, то образуется FeBr3. При нагревании FeСl3 и, особенно, FeBr3 отщепляют галоген и превращаются в галогениды железа (II). При взаимодействии железа и иода образуется иодид Fe3I8.
При нагревании железо реагирует с азотом, образуя нитрид железа Fe3N, с фосфором, образуя фосфиды FeP, Fe2P и Fe3P, с углеродом, образуя карбид Fe3C, с кремнием, образуя несколько силицидов, например, FeSi.
При повышенном давлении металлическое железо реагирует с монооксидом углерода СО, причем образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO)5. Известны также карбонилы железа составов Fe2(CO)9 и Fe3(CO)12. Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена (см. ФЕРРОЦЕН) состава [Fe(-C5H5)2].
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. В концентрированной серной и азотной кислотах железо не растворяется, так как прочная оксидная пленка пассивирует его поверхность.
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа (II):
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
При взаимодействии железа с приблизительно 70%-й серной кислотой реакция протекает с образованием сульфата железа (III):
2Fe + 4H2SO4 = Fe2(SO4)3 + SO2 + 4H2O
Оксид железа (II) FeО обладает основными свойствами, ему отвечает основание Fe(ОН)2. Оксид железа (III) Fe2O3 слабо амфотерен, ему отвечает еще более слабое, чем Fe(ОН)2, основание Fe(ОН)3, которое реагирует с кислотами:
2Fe(ОН)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
Гидроксид железа (III) Fe(ОН)3 проявляет слабо амфотерные свойства; он способен реагировать только с концентрированными растворами щелочей:
Fe(ОН)3 + КОН = К[Fe(ОН)4]
Образующиеся при этом гидроксокомплексы железа (III) устойчивы в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причем в осадок выпадает гидроксид железа (III) Fe(OH)3.
Соединения железа (III) в растворах восстанавливаются металлическим железом:
Fe + 2FeCl3 = 3FeCl2
При хранении водных растворов солей железа (II) наблюдается окисление железа (II) до железа (III):
4FeCl2 + O2 + 2H2O = 4Fe(OH)Cl2
Из солей железа (II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа (II) (NH4)2Fe(SO4)2·6Н2О.
Железо (III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (NH4)Fe(SO4)2 — железоаммонийные квасцы и т. д.
При действии газообразного хлора или озона на щелочные растворы соединений железа (III) образуются соединения железа (VI) — ферраты, например, феррат (VI) калия K2FeO4. Имеются сообщения о получении под действием сильных окислителей соединений железа (VIII).
Для обнаружения в растворе соединений железа (III) используют качественную реакцию ионов Fe3+ с тиоцианат-ионами CNS-. При взаимодействии ионов Fe3+ с анионами CNS- образуется ярко-красный роданид железа Fe(CNS)3. Другим реактивом на ионы Fe3+ служит гексацианоферрат (II) калия K4[Fe(CN)6] (ранее это вещество называли желтой кровяной солью). При взаимодействии ионов Fe3+ и [Fe(CN)6]4- выпадает ярко-синий осадок.
Реактивом на ионы Fe2+ в растворе может служить раствор гексацианоферрат (III) калия K3[Fe(CN)6], ранее называвшийся красной кровяной солью. При взаимодействии ионов Fe3+ и [Fe(CN)6]3- выпадает ярко-синий осадок такого же состава, как и в случае взаимодействия ионов Fe3+ и [Fe(CN)6]4-.
Сплавы железа с углеродом
Железо используется главным образом в сплавах, прежде всего в сплавах с углеродом — различных чугунах и сталях. В чугуне содержание углерода выше 2,14 % по массе (обычно — на уровне 3,5—4%), в сталях содержание углерода более низкое (обычно на уровне 0,8—1 %).
Чугун получают в домнах. Домна представляет собой гигантский (высотой до 30—40 м) усеченный конус, полый внутри. Стенки домны изнутри выложены огнеупорным кирпичом, толщина кладки составляет несколько метров. Сверху в домну вагонетками загружают обогащенную (освобожденную от пустой породы) железную руду, восстановитель кокс (каменный уголь специальных сортов, подвергнутый коксованию — нагреванию при температуре около 1000 °C без доступа воздуха), а также плавильные материалы (известняк и другие), способствующие отделению от выплавляемого металла примесей — шлака. Снизу в домну подают дутье (чистый кислород или воздух, обогащенный кислородом). По мере того, как загруженные в домну материалы опускаются, их температура поднимается до 1200—1300 °C. В результате реакций восстановления, протекающих главным образом с участием кокса С и СО:
Fe2O3 + 3C = 2Fe + 3CO;
Fe2O3 + 3CО = 2Fe + 3CO2
возникает металлическое железо, которое насыщается углеродом и стекает вниз.
Этот расплав периодически выпускают из домны через специальное отверстие — летку — и дают расплаву застыть в специальных формах. Чугун бывает белый, так называемый передельный (его используют для получения стали) и серый, или литьевой. Белый чугун — это твердый раствор углерода в железе. В микроструктуре серого чугуна можно различить микрокристаллики графита. Из-за наличия графита серый чугун оставляет след на белой бумаге.
Чугун хрупок, при ударе он колется, поэтому из него нельзя изготавливать пружины, рессоры, любые изделия, которые должны работать на изгиб.
Твердый чугун легче расплавленного, так что при его затвердевании происходит не сжатие (как обычно при затвердевании металлов и сплавов), а расширение. Эта особенность позволяет изготавливать из чугуна различные отливки, в том числе использовать его как материал для художественного литья.
Если содержание углерода в чугуне снизить до 1,0—1,5%, то образуется сталь. Стали бывают углеродистыми (в таких сталях нет других компонентов, кроме Fe и C) и легированными (такие стали содержат добавки хрома, никеля, молибдена, кобальта и других металлов, улучшающие механические и иные свойства стали).
Стали получают, перерабатывая чугун и металлический лом в кислородном конвертере, в электродуговой или мартеновской печах. При такой переработке снижается содержание углерода в сплаве до требуемого уровня, как говорят, избыточный углерод выгорает.
Физические свойства стали существенно отличаются от свойств чугуна: сталь упруга, ее можно ковать, прокатывать. Так как сталь, в отличие от чугуна, при затвердевании сжимается, то полученные стальные отливки подвергают обжатию на прокатных станах. После прокатки в объеме металла исчезают пустоты и раковины, появившиеся при затвердевании расплавов.
Производство сталей имеет в России давние глубокие традиции, и полученные нашими металлургами стали отличаются высоким качеством.
Применение железа, его сплавов и соединений
Чистое железо имеет довольно ограниченное применение. Его используют при изготовлении сердечников электромагнитов, как катализатор химических процессов, для некоторых других целей. Но сплавы железа — чугун и сталь — составляют основу современной техники. Находят широкое применение и многие соединения железа. Так, сульфат железа (III) используют при водоподготовке, оксиды и цианид железа служат пигментами при изготовлении красителей и так далее.
Железо в организме
Железо присутствует в организмах всех растений и животных как микроэлемент, (см. МИКРОЭЛЕМЕНТЫ) то есть в очень малых количествах (в среднем около 0,02%). Однако железобактерии (см. ЖЕЛЕЗОБАКТЕРИИ), использующие энергию окисления железа (II) в железо (III) для хемосинтеза (см. ХЕМОСИНТЕЗ), могут накапливать в своих клетках до 17—20% железа. Основная биологическая функция железа — участие в транспорте кислорода и окислительных процессах. Эту функцию железо выполняет в составе сложных белков — гемопротеидов (см. ГЕМОПРОТЕИДЫ), простетической группой которых является железопорфириновый комплекс — гем (см. ГЕМ). Среди важнейших гемопротеидов дыхательные пигменты гемоглобин (см. ГЕМОГЛОБИН) и миоглобин, (см. МИОГЛОБИН) универсальные переносчики электронов в реакциях клеточного дыхания, окисления и фотосинеза цитохромы, (см. ЦИТОХРОМЫ) ферменты каталоза и пероксида, и других. У некоторых беспозвоночных железосодержащие дыхательные пигменты гелоэритрин и хлорокруорин имеют отличное от гемоглобинов строение. При биосинтезе гемопротеидов железо переходит к ним от белка ферритина (см. ФЕРРИТИН), осуществляющего запасание и транспорт железа. Этот белок, одна молекула которого включает около 4 500 атомов железа, концентрируется в печени, селезенке, костном мозге и слизистой кишечника млекопитающих и человека. Суточная потребность человека в железе (6—20 мг) с избытком покрывается пищей (железом богаты мясо, печень, яйца, хлеб, шпинат, свекла и другие). В организме среднего человека (масса тела 70 кг) содержится 4,2 г железа, в 1 л крови — около 450 мг. При недостатке железа в организме развивается железистая анемия, которую лечат с помощью препаратов, содержащих железо. Препараты железа применяются и как общеукрепляющие средства. Избыточная доза железа (200 мг и выше) может оказывать токсичное действие. Железо также необходимо для нормального развития растений, поэтому существуют микроудобрения на основе препаратов железа.
Энциклопедический словарь. 2009.
