- водород
- ВОДОРО́Д -а; м. Химический элемент (H), лёгкий газ без цвета и запаха, образующий в соединении с кислородом воду.◁ Водоро́дный, -ая, -ое. В-ые соединения. В-ые бактерии. В-ая бомба (бомба огромной разрушительной силы, взрывное действие которой основано на термоядерной реакции). Водоро́дистый, -ая, -ое.* * *водоро́д(лат. Hydrogenium), химический элемент VII группы периодической системы. В природе встречаются два стабильных изотопа (протий и дейтерий) и один радиоактивный (тритий). Молекула двухатомна (Н2). Газ без цвета и запаха; плотность 0,0899 г/л, tкип — 252,76°C. Соединяется с многими элементами, с кислородом образует воду. Самый распространённый элемент космоса; составляет (в виде плазмы) более 70% массы Солнца и звёзд, основная часть газов межзвёздной среды и туманностей. Атом водорода входит в состав многих кислот и оснований, большинства органических соединений. Применяют в производстве аммиака, соляной кислоты, для гидрогенизации жиров и др., при сварке и резке металлов. Перспективен как горючее (см. Водородная энергетика).
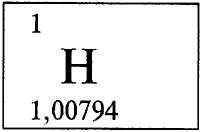 * * *ВОДОРОДВОДОРО́Д (лат. Hydrogenium), H, химический элемент с атомным номером 1, атомная масса 1,00794. Химический символ водорода Н читается в нашей стране «аш», как произносится эта буква по-французски.
* * *ВОДОРОДВОДОРО́Д (лат. Hydrogenium), H, химический элемент с атомным номером 1, атомная масса 1,00794. Химический символ водорода Н читается в нашей стране «аш», как произносится эта буква по-французски.
Природный водород состоит из смеси двух стабильных нуклидов (см. НУКЛИД)с массовыми числами 1,007825 (99,985 % в смеси) и 2,0140 (0,015 %). Кроме того, в природном водороде всегда присутствуют ничтожные количества радиоактивного нуклида — трития (см. ТРИТИЙ) 3Н (период полураспада Т1/212,43 года). Так как в ядре атома водорода содержится только 1 протон (меньше в ядре атома элемента протонов быть не может), то иногда говорят, что водород образует естественную нижнюю границу периодической системы элементов Д. И. Менделеева (хотя сам элемент водород расположен в самой верхней части таблицы). Элемент водород расположен в первом периоде таблицы Менделеева. Его относят и к 1-й группе (группе IА щелочных металлов (см. ЩЕЛОЧНЫЕ МЕТАЛЛЫ)), и к 7-й группе (группе VIIA галогенов (см. ГАЛОГЕНЫ)).
Массы атомов у изотопов водорода различаются между собой очень сильно (в разы). Это приводит к заметным различиям в их поведении в физических процессах (дистилляция, электролиз и др.) и к определенным химическим различиям (различия в поведении изотопов одного элемента называют изотопными эффектами, для водорода изотопные эффекты наиболее существенны). Поэтому в отличие от изотопов всех остальных элементов изотопы водорода имеют специальные символы и названия. Водород с массовым числом 1 называют легким водородом, или протием (лат. Protium, от греческого protos — первый), обозначают символом Н, а его ядро называют протоном (см. ПРОТОН (элементарная частица)), символ р. Водород с массовым числом 2 называют тяжелым водородом, дейтерием (см. ДЕЙТЕРИЙ)(лат Deuterium, от греческого deuteros — второй), для его обозначения используют символs 2Н, или D (читается «де»), ядро d — дейтрон. Радиоактивный изотоп с массовым числом 3 называют сверхтяжелым водородом, или тритием (лат. Tritum, от греческого tritos — третий), символ 2Н или Т (читается «те»), ядро t — тритон.
Конфигурация единственного электронного слоя нейтрального невозбужденного атома водорода 1s1. В соединениях проявляет степени окисления +1 и, реже, –1 (валентность I). Радиус нейтрального атома водорода 0,024 нм. Энергия ионизации атома 13,595 эВ, сродство к электрону 0,75 эВ. По шкале Полинга электроотрицательность водорода 2,20. Водород принадлежит к числу неметаллов.
В свободном виде — легкий горючий газ без цвета, запаха и вкуса.
История открытия
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в 16 и 17 веках на заре становления химии как науки. Знаменитый английский физик и химик Г. Кавендиш (см. КАВЕНДИШ Генри)в 1766 исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона (см. ФЛОГИСТОН)помешала ему сделать правильные выводы. Французский химик А. Лавуазье (см. ЛАВУАЗЬЕ Антуан Лоран)совместно с инженером Ж. Менье (см. МЕНЬЕ Жан Батист Мари Шарль), используя специальные газометры, в 1783 осуществил синтез воды, а затем и ее анализ, разложив водяной пар раскаленным железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из нее получен. В 1787 Лавуазье пришел к выводу, что «горючий воздух» представляет собой простое вещество, и, следовательно, относится к числу химических элементов. Он дал ему название hydrogene (от греческого hydor — вода и gennao — рождаю) — «рождающий воду». Установление состава воды положило конец «теории флогистона». Русское наименование «водород» предложил химик М. Ф. Соловьев (см. СОЛОВЬЕВ Михаил Федорович) в 1824. На рубеже 18 и 19 веков было установлено, что атом водорода очень легкий (по сравнению с атомами других элементов), и вес (масса) атома водорода был принят за единицу сравнения атомных масс элементов. Массе атома водорода приписали значение, равное 1.
Нахождение в природе
На долю водорода приходится около 1% массы земной коры (10-е место среди всех элементов). В свободном виде водород на нашей планете практически не встречается (его следы имеются в верхних слоях атмосферы), но в составе воды распространен на Земле почти повсеместно. Элемент водород входит в состав органических и неорганических соединений живых организмов, природного газа, нефти, каменного угля. Он содержится, разумеется, в составе воды (около 11% по массе), в различных природных кристаллогидратах и минералах, в составе которых имеется одна или несколько гидроксогрупп ОН.
Водород как элемент доминирует во Вселенной. На его долю приходится около половины массы Солнца и других звезд, он присутствует в атмосфере ряда планет.
Получение
Водород можно получить многими способами. В промышленности для этого используют природные газы, а также газы, получаемые при переработке нефти, коксовании и газификации угля и других топлив. При производстве водорода из природного газа (основной компонент — метан) проводят его каталитическое взаимодействие с водяным паром и неполное окисление кислородом:
CH4 + H2O = CO + 3H2 и CH4 + 1/2 O2 = CO2 + 2H2
Выделение водорода из коксового газа и газов нефтепереработки основано на их сжижении при глубоком охлаждении и удалении из смеси газов, сжижаемых легче, чем водород. При наличии дешевой электроэнергии водород получают электролизом воды, пропуская ток через растворы щелочей. В лабораторных условиях водород легко получить взаимодействием металлов с кислотами, например, цинка с соляной кислотой.
Физические и химические свойства
При обычных условиях водород — легкий (плотность при нормальных условиях 0,0899 кг/м3) бесцветный газ. Температура плавления –259,15 °C, температура кипения –252,7 °C. Жидкий водород (при температуре кипения) обладает плотностью 70,8 кг/м3 и является самой легкой жидкостью. Стандартный электродный потенциал Н2/Н- в водном растворе принимают равным 0. Водород плохо растворим в воде: при 0 °C растворимость составляет менее 0,02 см3/мл, но хорошо растворим в некоторых металлах (губчатое железо и других), особенно хорошо — в металлическом палладии (около 850 объемов водорода в 1 объеме металла). Теплота сгорания водорода равна 143,06 МДж/кг.
Существует в виде двухатомных молекул Н2. Константа диссоциации Н2 на атомы при 300 К 2,56·10-34. Энергия диссоциации молекулы Н2 на атомы 436 кДж/моль. Межъядерное расстояние в молекуле Н2 0,07414 нм.
Так как ядро каждого атома Н, входящего в состав молекулы, имеет свой спин (см. СПИН) , то молекулярный водород может находиться в двух формах: в форме ортоводорода (о-Н2) (оба спина имеют одинаковую ориентацию) и в форме параводорода (п-Н2) (спины имеют разную ориентацию). При обычных условиях нормальный водород представляет собой смесь 75% о-Н2 и 25% п-Н2. Физические свойства п- и о-Н2 немного различаются между собой. Так, если температура кипения чистого о-Н2 20,45 К, то чистого п-Н2 — 20,26 К. Превращение о-Н2 в п-Н2 сопровождается выделением 1418 Дж/моль теплоты.
В научной литературе неоднократно высказывались соображения о том, что при высоких давлениях (выше 10 ГПа) и при низких температурах (около 10 К и ниже) твердый водород, обычно кристаллизующийся в гексагональной решетке молекулярного типа, может переходить в вещество с металлическими свойствами, возможно, даже сверхпроводник. Однако пока однозначных данных о возможности такого перехода нет.
Высокая прочность химической связи между атомами в молекуле Н2 (что, например, используя метод молекулярных орбиталей, можно объяснить тем, что в этой молекуле электронная пара находится на связывающей орбитали, а разрыхляющая орбиталь электронами не заселена) приводит к тому, что при комнатной температуре газообразный водород химически малоактивен. Так, без нагревания, при простом смешивании водород реагирует (со взрывом) только с газообразным фтором:
H2 + F2 = 2HF + Q.
Если смесь водорода и хлора при комнатной температуре облучить ультрафиолетовым светом, то наблюдается немедленное образование хлороводорода НСl. Реакция водорода с кислородом происходит со взрывом, если в смесь этих газов внести катализатор — металлический палладий (или платину). При поджигании смесь водорода и кислорода (так называемый гремучий газ (см. ГРЕМУЧИЙ ГАЗ)) взрывается, при этом взрыв может произойти в смесях, в которых содержание водорода составляет от 5 до 95 объемных процентов. Чистый водород на воздухе или в чистом кислороде спокойно горит с выделением большого количества теплоты:
H2 + 1/2O2 = Н2О + 285,75 кДж/моль
С остальными неметаллами и металлами водород если и взаимодействует, то только при определенных условиях (нагревание, повышенное давление, присутствие катализатора). Так, с азотом водород обратимо реагирует при повышенном давлении (20—30 МПа и больше) и при температуре 300—400 °C в присутствии катализатора — железа:
3H2 + N2 = 2NH3 + Q.
Также только при нагревании водород реагирует с серой с образованием сероводорода H2S, с бромом — с образованием бромоводорода НBr, с иодом — с образованием иодоводорода НI. С углем (графитом) водород реагирует с образованием смеси углеводородов различного состава. С бором, кремнием, фосфором водород непосредственно не взаимодействует, соединения этих элементов с водородом получают косвенными путями.
При нагревании водород способен вступать в реакции с щелочными, щелочноземельными металлами и магнием с образованием соединений с ионным характером связи, в составе которых содержится водород в степени окисления –1. Так, при нагревании кальция в атмосфере водорода образуется солеобразный гидрид состава СаН2. Полимерный гидрид алюминия (AlH3)x — один из самых сильных восстановителей — получают косвенными путями (например, с помощью алюминийорганических соединений). Со многими переходными металлами (например, цирконием, гафнием и др.) водород образует соединения переменного состава (твердые растворы).
Водород способен реагировать не только со многими простыми, но и со сложными веществами. Прежде всего надо отметить способность водорода восстанавливать многие металлы из их оксидов (такие, как железо, никель, свинец, вольфрам, медь и др.). Так, при нагревании до температуры 400—450 °C и выше происходит восстановление железа водородом из его любого оксида, например:
Fe2O3 + 3H2 = 2Fe + 3H2O.
Следует отметить, что восстановить водородом из оксидов можно только металлы, расположенные в ряду стандартных потенциалов за марганцем. Более активные металлы (в том числе и марганец) до металла из оксидов не восстанавливаются.
Водород способен присоединяться по двойной или тройной связи ко многим органическим соединениям (это — так называемые реакции гидрирования). Например, в присутствии никелевого катализатора можно осуществить гидрирование этилена С2Н4, причем образуется этан С2Н6:
С2Н4 + Н2 = С2Н6.
Взаимодействием оксида углерода(II) и водорода в промышленности получают метанол:
2Н2 + СО = СН3ОН.
В соединениях, в которых атом водорода соединен с атомом более электроотрицательного элемента Э (Э = F, Cl, O, N), между молекулами образуются водородные связи (см. ВОДОРОДНАЯ СВЯЗЬ) (два атома Э одного и того же или двух разных элементов связаны между собой через атом Н: Э"... Н... Э"", причем все три атома расположены на одной прямой). Такие связи существуют между молекулами воды, аммиака, метанола и др. и приводят к заметному возрастанию температур кипения этих веществ, увеличению теплоты испарения и т. д.
Применение
Водород используют при синтезе аммиака NH3, хлороводорода HCl, метанола СН3ОН, при гидрокрекинге (крекинге в атмосфере водорода) природных углеводородов, как восстановитель при получении некоторых металлов. Гидрированием (см. ГИДРИРОВАНИЕ) природных растительных масел получают твердый жир — маргарин. Жидкий водород находит применение как ракетное топливо, а также как хладагент. Смесь кислорода с водородом используют при сварке.
Одно время высказывалось предположение, что в недалеком будущем основным источником получения энергии станет реакция горения водорода, и водородная энергетика вытеснит традиционные источники получения энергии (уголь, нефть и др.). При этом предполагалось, что для получения водорода в больших масштабах можно будет использовать электролиз воды. Электролиз воды — довольно энергоемкий процесс, и в настоящее время получать водород электролизом в промышленных масштабах невыгодно. Но ожидалось, что электролиз будет основан на использовании среднетемпературной (500—600 °C) теплоты, которая в больших количествах возникает при работе атомных электростанций. Эта теплота имеет ограниченное применение, и возможности получения с ее помощью водорода позволили бы решить как проблему экологии (при сгорании водорода на воздухе количество образующихся экологически вредных веществ минимально), так и проблему утилизации среднетемпературной теплоты. Однако после Чернобыльской катастрофы развитие атомной энергетики повсеместно свертывается, так что указанный источник энергии становится недоступным. Поэтому перспективы широкого использования водорода как источника энергии пока сдвигаются по меньшей мере до середины 21-го века.
Особенности обращения
Водород не ядовит, но при обращении с ним нужно постоянно учитывать его высокую пожаро- и взрывоопасность, причем взрывоопасность водорода повышена из-за высокой способности газа к диффузии даже через некоторые твердые материалы. Перед началом любых операций по нагреванию в атмосфере водорода следует убедиться в его чистоте (при поджигании водорода в перевернутой вверх дном пробирке звук должен быть глухой, а не лающий).
Биологическая роль
Биологическое значение водорода определяется тем, что он входит в состав молекул воды и всех важнейших групп природных соединений, в том числе белков, нуклеиновых кислот, липидов, углеводов. Примерно 10 % массы живых организмов приходится на водород. Способность водорода образовывать водородную связь играет решающую роль в поддержании пространственной четвертичной структуры белков, а также в осуществлении принципа комплементарности (см. КОМПЛЕМЕНТАРНОСТЬ)в построении и функциях нуклеиновых кислот (то есть в хранении и реализации генетической информации), вообще в осуществлении «узнавания» на молекулярном уровне. Водород (ион Н+) принимает участие в важнейших динамических процессах и реакциях в организме — в биологическом окислении, обеспечивающим живые клетки энергией, в фотосинтезе у растений, в реакциях биосинтеза, в азотфиксации и бактериальном фотосинтезе, в поддержании кислотно-щелочного равновесия и гомеостаза (см. ГОМЕОСТАЗ), в процессах мембранного транспорта. Таким образом, наряду с кислородом и углеродом водород образует структурную и функциональную основы явлений жизни.
Энциклопедический словарь. 2009.
