- МОЛЕКУЛЯРНЫЕ КOМПЛЕКСЫ
-
(донорно-акцепторные комплексы, мол. соединения), образуются из формально валентно-насыщ. молекул благодаря силам межмолекулярного взаимодействия. Совр. представления о М. к. значительно шире того, что заложено в их названии, т. к. в М. к. могут входить ионы, своб. радикалы, ион-радикалы, а также молекулы в возбужденном состоянии (см. Эксимеры, Экси-плексы); к М. к. относятся и комплексы с водородной связью (см. Водородная связь). М. к. имеют вполне определенную стехиометрию и пространств. строение, при этом исходный состав входящих в М. к. молекул сохраняется. Часто М. к. рассматривают как своеобразный тип координац. соед., в к-рый наряду с соед. металлов (см. Металлоорганические соединения )входят и комплексы, состоящие исключительно из орг. соед. или неметаллов.
Обычно М. к. отличают от клатратов, у к-рых чаще всего менее определенная стехиометрия и энергия межмолекулярного взаимод. не превышает энергию ван-дер-ваальсова взаимодействия. Однако это отличие довольно условно, т. к. относит. прочность М. к., по к-рой они делятся на сильные и слабые, изменяется в весьма широком диапазоне и бывает соизмерима как с энергией ван-дер-ваальсова взаимод., так и с энергией хим. связи. Напр., энтальпия образования DH0K для слабого М. к. (C6H5)2S.I2 всего -1,25 кДж/моль, а для сильного М. к. 4-C2H5C5H4N. АlВr3 порядка -200 кДж/моль.
Прочность связи и др. физ.-хим. св-ва М. к. трактуют с позиций образования в них донорно-акцепторной связи, обусловленной перекрыванием мол. орбиталей (МО) донора (Д) и акцептора (А) электронов в молекуле М. к.
В соответствии с природой орбиталей, участвующих в образовании донорно-акцепторной связи, Д и А подразделяют на неск. групп (Р. Малликен): n-доноры, образующие связь за счет неподеленной электронной пары гетероатома (напр., амины, эфиры, сульфиды); p-доноры, предоставляющие p-электроны (напр., ароматич. углеводороды); s-доноры, предоставляющие пару электронов s-связи (напр., гало-генуглеводороды); u-акцепторы, принимающие электрон на вакантную орбиталь атома металла (напр., АlНаl3 и др. к-ты Льюиса); s-акцепторы, предоставляющие разрыхляющую s-орбиталь (галогены); я-акцепторы, принимающие электрон на p-орбиталь (хиноны, ароматич. нитрилы и карбонильные соед.). Примеры М. к.: типа nu-R3PO.PF5, ns-R2S.I2, pu-С 6 Н 6. АlСl3. Согласно теории Малликена, основное (N)и возбужденное (Е)состояния М. к. состава ДА описываются соотв. волновыми ф-циями yN и yE:
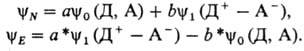
Ф-ция y0 описывает гипотетич. состояние системы "без связи", когда расстояние между молекулами Д и А равно длине донорно-акцепторной связи, а взаимод. между ними только электростатическое. Ф-ция y1 описывает состояние, в к-ром один из электронов с МО донора y Д перенесен без изменения спина на МО акцептора y Д, оставаясь спаренным со вторым электроном на МО y Д, в результате чего образуется ковалентная связь. Суперпозиция гипотетич. состояний, отвечающих y1 и y0, соответствует реальному состоянию М. к.
Переход из основного состояния в возбужденное связан с увеличением вклада состояния y1 (а* >> b*) и сопровождается резким увеличением степени переноса заряда. Для ряда М. к. характерно появление в электронных спектрах новой полосы поглощения, отсутствовавшей в спектрах индивидуальных Д и А, называемой п о л о с о й п е р е н о с а з а - р я д а. Не все М. к. имеют полосу переноса заряда, а в ряде случаев ее трудно фиксировать из-за собств. поглощения Д или А. Получены линейные ур-ния, связывающие энергию hv, соответствующую полосе переноса заряда с потенциалом ионизации донора I Д для М. к. типа sn, ss, ps. Наиб. полное полуэмпирич. ур-ние hv = I Д Ч Е А + С включает в себя Е А- сродство к электрону акцептора и постоянную С.
м. к. часто называют к о м п л е к с а м и с п е р е н о с о м з а р я д а (КПЗ), хотя перенос заряда не является единственным или обязательно главным фактором устойчивости М. к. в основном состоянии. Лишь для М. к. типа pp (p-к о м пл е к с о в), полученных взаимод. сильных p-доноров и p-акцепторов, уже в основном состоянии реализуется почти полный перенос заряда и образуются устойчивые ион-радикальные пары, или и о н-р а д и к а л ь н ы е с о л и, наз. также металлами органическими, т. к. их проводимость в определенном температурном интервале близка к металлической. Синтез таких солей осуществляют целенаправленно, исходя из экспериментально установленных оптим. значений (I Д - E А) ~ 4 эВ и энергий для полосы переноса заряда hv, соответствующей l
 1000-1500 нм. На основании этих систем ведутся поиски новых оптич. материалов (светофильтров), материалов с полупроводниковыми сверхпрово-дящими св-вами (напр., ДА, где Д - тетрахалькогенофульва-лены с I д ~ 6,3-6,8 эВ и А - тетрацианоэтилен, циано- и галогенопроизводные дихинонов с E А ~ 1,8-3 эВ). Методом мёссбауэровской спектроскопии (для твердых быстрозаморо-женных р-ров) установлено отсутствие переноса заряда в нек-рых слабых М. к. типа ss (напр., ССl4.I2, С 6 Н 14.I2); заметные значения имеют величины переноса заряда для М. к. типа ps, пs;макс. значения переноса заряда (порядка 0,2-0,5 е и выше) наблюдаются в сильных М. к. типа nu.Такое деление М. к. по величине переноса заряда носит качеств. характер, т. к. величины переноса заряда, полученные для одних и тех же М. к. разл. методами (ИК, ЯКР, мёссбауэровской, фотоэлектронной спектроскопией, определением дипольных моментов), часто существенно отличаются друг от друга. Это объясняется не только разл. условиями эксперимента, но также и тем, что каждый метод связан с определенными допущениями, роль к-рых не поддается точной оценке. Простая и наглядная модель М. к. Малликена, породившая множество полуэмпирич. соотношений, носит качеств. характер. Количеств. теоретич. расчеты М. к. осуществляют методами МО ЛКАО и ССП МО ЛКАО (см. Молекулярных орбиталей методы). Выявление доминирующего фактора в определении прочности М. к. или его структуры проводится в рамках модельного разложения полной энергии взаимод. (E вз) для системы (Д + А) на составляющие:
1000-1500 нм. На основании этих систем ведутся поиски новых оптич. материалов (светофильтров), материалов с полупроводниковыми сверхпрово-дящими св-вами (напр., ДА, где Д - тетрахалькогенофульва-лены с I д ~ 6,3-6,8 эВ и А - тетрацианоэтилен, циано- и галогенопроизводные дихинонов с E А ~ 1,8-3 эВ). Методом мёссбауэровской спектроскопии (для твердых быстрозаморо-женных р-ров) установлено отсутствие переноса заряда в нек-рых слабых М. к. типа ss (напр., ССl4.I2, С 6 Н 14.I2); заметные значения имеют величины переноса заряда для М. к. типа ps, пs;макс. значения переноса заряда (порядка 0,2-0,5 е и выше) наблюдаются в сильных М. к. типа nu.Такое деление М. к. по величине переноса заряда носит качеств. характер, т. к. величины переноса заряда, полученные для одних и тех же М. к. разл. методами (ИК, ЯКР, мёссбауэровской, фотоэлектронной спектроскопией, определением дипольных моментов), часто существенно отличаются друг от друга. Это объясняется не только разл. условиями эксперимента, но также и тем, что каждый метод связан с определенными допущениями, роль к-рых не поддается точной оценке. Простая и наглядная модель М. к. Малликена, породившая множество полуэмпирич. соотношений, носит качеств. характер. Количеств. теоретич. расчеты М. к. осуществляют методами МО ЛКАО и ССП МО ЛКАО (см. Молекулярных орбиталей методы). Выявление доминирующего фактора в определении прочности М. к. или его структуры проводится в рамках модельного разложения полной энергии взаимод. (E вз) для системы (Д + А) на составляющие: 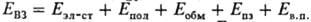 , где E эл-ст -энергия электростатич. взаимод., Е пол - поляризационная энергия, Е обм - энергия обменного взаимод., Е пз -энергия, связанная с переносом заряда, Е в. п -энергия высших порядков, определяемая как разность между Е вз и первых четырех членов разложения. На основании количеств. оценки отдельных вкладов в Е вз,полученной на основе расчетов ab initio (см. Неэмпирические методы )для широкой серии М. к. разного типа, К. Морокума классифицировал М. к.: по значениям энергии связи-как сильные (сотни кДж/моль, типа nu,su), средние (десятки кДж/моль, типа ns, pp, пp), слабые (единицы кДж/моль, типа ns, ps, pp); по природе связи (т. е. по наиб. вкладу в E вз )-как электростатические, поляризационные, с переносом заряда. При этом М. к. каждого типа м. б. как сильные, так и слабые. Подобная классификация М. к. весьма условна, т. к. разделение E вз на составляющие даже в расчетах ab initio сильно зависит от применяемого в расчете базисного набора волновых ф-ций. Изучение М. к. имеет важное практич. значение для решения энергетич. и экологич. проблем - утилизации солнечной энергии, аккумулирования электрич. энергии, разработки новых методов переработки руд, угля. М. к. используют как катализаторы, в аналит. химии, электронике, фармакологии, гидрометаллургии и др. По мнению А. Сент-Дьёр-дя, глиоксалевые производные, обнаруживаемые во всех живых клетках, являются акцепторами для белков и ответственны за перевод клеток из анаэробного состояния в аэробное. Затем роль акцептора берет на себя кислород, к-рый обладает значительно большим, чем глиоксаль, сродством к электрону. Известные эксперим. факты указывают на важную роль М. к. в ферментативных р-циях в биоэнергетике в целом.
, где E эл-ст -энергия электростатич. взаимод., Е пол - поляризационная энергия, Е обм - энергия обменного взаимод., Е пз -энергия, связанная с переносом заряда, Е в. п -энергия высших порядков, определяемая как разность между Е вз и первых четырех членов разложения. На основании количеств. оценки отдельных вкладов в Е вз,полученной на основе расчетов ab initio (см. Неэмпирические методы )для широкой серии М. к. разного типа, К. Морокума классифицировал М. к.: по значениям энергии связи-как сильные (сотни кДж/моль, типа nu,su), средние (десятки кДж/моль, типа ns, pp, пp), слабые (единицы кДж/моль, типа ns, ps, pp); по природе связи (т. е. по наиб. вкладу в E вз )-как электростатические, поляризационные, с переносом заряда. При этом М. к. каждого типа м. б. как сильные, так и слабые. Подобная классификация М. к. весьма условна, т. к. разделение E вз на составляющие даже в расчетах ab initio сильно зависит от применяемого в расчете базисного набора волновых ф-ций. Изучение М. к. имеет важное практич. значение для решения энергетич. и экологич. проблем - утилизации солнечной энергии, аккумулирования электрич. энергии, разработки новых методов переработки руд, угля. М. к. используют как катализаторы, в аналит. химии, электронике, фармакологии, гидрометаллургии и др. По мнению А. Сент-Дьёр-дя, глиоксалевые производные, обнаруживаемые во всех живых клетках, являются акцепторами для белков и ответственны за перевод клеток из анаэробного состояния в аэробное. Затем роль акцептора берет на себя кислород, к-рый обладает значительно большим, чем глиоксаль, сродством к электрону. Известные эксперим. факты указывают на важную роль М. к. в ферментативных р-циях в биоэнергетике в целом.
Лит.: Гурьянова Е. Н., Гольдштейн И. П., Ромм И. П., Донорно-ак-цепторная связь, М., 1973; Полещук О. Х., Максютин Ю. К., "Успехи химии", 1976, т. 45, в. 12, с. 2097-2120; Молекулярные взаимодействия, под ред. Г. Ратайчика, В. Орвилл-Томаса, пер. с англ., М., 1984; Успехи химии комплексов с переносом заряда и ион-радикальных солей (КОМИС-5), под ред. М. Л. Хидекеля, А. В. Булатова, Черноголовка, 1986; Хобза П., Заград-ник Р., Межмолекулярные комплексы, пер. с англ., М., 1990; Mulliken R. S., Person W. В., Molecular compounds, N.Y., 1969. См. также лит. при статьях Межмолекулярные взаимодействия, Металлы органические. В. А. Коган.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
