- Сопряжение связей
-
один из важнейших видов внутримолекулярного взаимного влияния атомов и связей в органических соединениях; обусловлено взаимодействием электронных систем атомов (прежде всего валентных электронов, см. Валентность). Главный признак сопряжения — распределение по всей сопряжённой системе электронной плотности, создаваемой р- и π-электронами. Такими системами являются: чередующиеся простая и кратные связи — двойные или тройные; см. Простая связь, Кратные связи (π,π-сопряжение, как, например, в бутадиене, I; здесь и далее жирными штрихами, а также точками выделена сопряжённая система); кратная связь и атом со свободной электронной парой (р, π-сопряжение, например в винилхлориде, II); крестная связь и способная к сопряжению простая связь (σ, π-сопряжение, например в хлормеркурацетальдегиде, III); две способные к сопряжению простые связи (σ, σ-сопряжение, например в этанолмеркурхлориде, IV). Такая классификация сопряжённых систем предложена в начале 50-х гг. 20 в. А. Н. Несмеяновым.
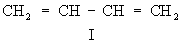


 Общая особенность всех сопряжённых систем — «растекание» электронной плотности р- и π-электронов (см. Сигма- и пи-связи) по всей сопряжённой системе — определяет их физические и химические свойства. Так, простые связи приобретают некоторую «двоесвязность», выражающуюся, в частности, в уменьшении их длины. Например, в бутадиене длина центральной С — С-связи 1,46 Å вместо обычной 1,54 Å. С. с. проявляется также, например, в УФ- и ИК-спектрах, дипольных моментах. Наиболее характерная химическая особенность сопряжённых систем — способность вступать в реакции не только с участием одной кратной связи, но и всей сопряжённой системы как единого целого. Примером может служить, например, присоединение к бутадиену хлористого водорода:
Общая особенность всех сопряжённых систем — «растекание» электронной плотности р- и π-электронов (см. Сигма- и пи-связи) по всей сопряжённой системе — определяет их физические и химические свойства. Так, простые связи приобретают некоторую «двоесвязность», выражающуюся, в частности, в уменьшении их длины. Например, в бутадиене длина центральной С — С-связи 1,46 Å вместо обычной 1,54 Å. С. с. проявляется также, например, в УФ- и ИК-спектрах, дипольных моментах. Наиболее характерная химическая особенность сопряжённых систем — способность вступать в реакции не только с участием одной кратной связи, но и всей сопряжённой системы как единого целого. Примером может служить, например, присоединение к бутадиену хлористого водорода: Количество образующихся продуктов 1,2-и 1,4-присоединения зависит от природы сопряжённой системы, от реагента и условий реакции. Сопряжение снижает внутреннюю энергию молекул и, следовательно, делает их более устойчивыми: величина энергии сопряжения колеблется между несколькими единицами и десятками ккал/моль (например, для бутадиена 3,6 ккал/моль, для бензола 35 ккал/моль, 1 ккал/моль =4,19 кдж/моль).Истинное распределение электронной плотности в сопряжённых системах нельзя выразить простейшими структурными формулами. Их строение более точно передаётся наборами предельных структур (см. Мезомерия, Резонанса теория), формулами с пунктирными («полуторными») связями или с изогнутыми стрелками, указывающими направление сдвига электронов, например:
Количество образующихся продуктов 1,2-и 1,4-присоединения зависит от природы сопряжённой системы, от реагента и условий реакции. Сопряжение снижает внутреннюю энергию молекул и, следовательно, делает их более устойчивыми: величина энергии сопряжения колеблется между несколькими единицами и десятками ккал/моль (например, для бутадиена 3,6 ккал/моль, для бензола 35 ккал/моль, 1 ккал/моль =4,19 кдж/моль).Истинное распределение электронной плотности в сопряжённых системах нельзя выразить простейшими структурными формулами. Их строение более точно передаётся наборами предельных структур (см. Мезомерия, Резонанса теория), формулами с пунктирными («полуторными») связями или с изогнутыми стрелками, указывающими направление сдвига электронов, например: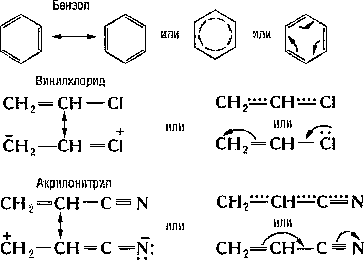 Для проявления С. с. необходимо, чтобы участвующие в нём электронные системы находились в одной плоскости. Если структура молекулы не допускает этого, то говорят о пространственных препятствиях сопряжению. Так, у Транс-стильбена (а), по данным УФ-спектров, обнаруживается более сильное сопряжение, чем у Цис-стильбена (б), у которого бензольные ядра не могут разместиться в одной плоскости с двойной связью:
Для проявления С. с. необходимо, чтобы участвующие в нём электронные системы находились в одной плоскости. Если структура молекулы не допускает этого, то говорят о пространственных препятствиях сопряжению. Так, у Транс-стильбена (а), по данным УФ-спектров, обнаруживается более сильное сопряжение, чем у Цис-стильбена (б), у которого бензольные ядра не могут разместиться в одной плоскости с двойной связью:
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
